研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
外泌体新角度!不卷传统治疗,盯紧小胶质细胞重编程,研究超吸眼球!
183 人阅读发布时间:2025-12-04 11:30
脑出血(ICH)是一种致死率极高的神经系统疾病,核心病理机制为失控的神经炎症和继发性脑损伤,目前缺乏有效治疗手段。小胶质细胞作为大脑固有免疫细胞,在 ICH 后会快速极化为促炎表型,通过NF-κB/NOS2信号通路释放炎症因子和一氧化氮,加剧神经元凋亡与血肿周围水肿。人脐带间充质干细胞来源外泌体(hUMSC-Exos)具备跨血脑屏障递送生物活性物质、调控炎症反应的优势,在缺血性中风等模型中已展现神经保护作用,但在ICH中的作用及机制尚未完全明确。

今天分享的是发表在【J Transl Med】(IF:7.5)上题为“Human umbilical MSC-derived exosomes improve intracerebral hemorrhage recovery via SIRT1-driven suppression ofNF-KB/NOS2 signaling: coordinating microglial homeostasis and neuroprotection”的研究。该研究旨在探究hUMSC-Exos经鼻内递送对ICH小鼠的治疗效果,阐明其调控小胶质细胞稳态和神经保护的分子机制,为ICH提供新型无细胞治疗策略。
研究结果
1、hUMSC-Exos的表征及ICH后鼻内递送的脑摄取情况
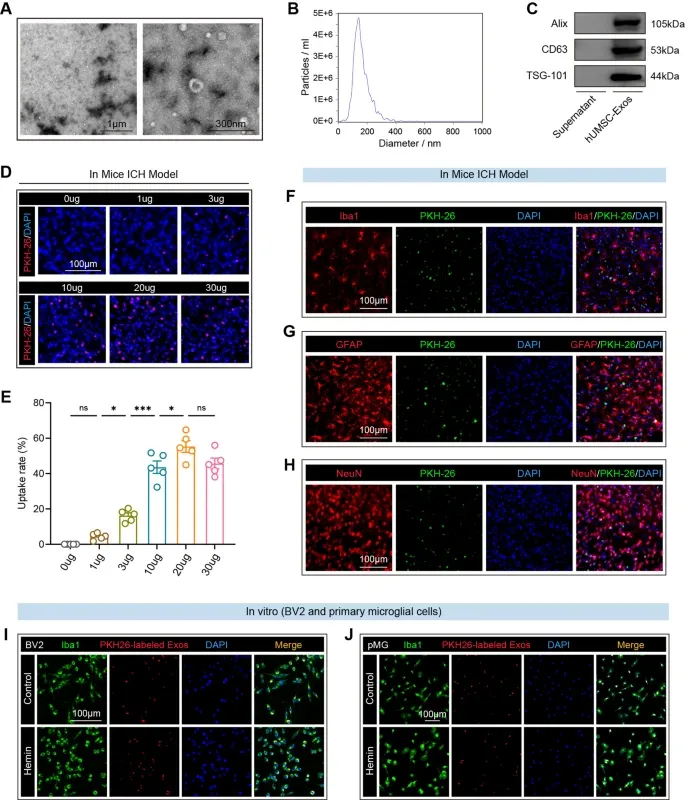
图1A:透射电镜显示,分离的hUMSC-Exos呈典型杯状形态。
图1B:纳米颗粒追踪分析(NTA)显示,hUMSC-Exos粒径分布均一,峰值直径约140-150nm。
图1C:Western blot分析hUMSC-Exos外泌体标志物Alix、CD63和TSG101的表达。
图1D:免疫荧光图像显示,PKH26标记的hUMSC-Exos在ICH小鼠血肿周围区域与DAPI共定位。
图1E:定量分析显示,鼻内递送12小时后,hUMSC-Exos在缺血半暗带呈剂量依赖性积累,20μg时达峰值。
图1F:免疫荧光显示,PKH26⁺hUMSC-Exos与血肿周围Iba1⁺小胶质细胞共定位。
图1G:免疫荧光显示,PKH26⁺hUMSC-Exos与GFAP⁺星形胶质细胞共定位。
图1H:免疫荧光显示,PKH26⁺hUMSC-Exos与NeuN⁺神经元共定位。
图1I:体外实验显示,BV2小胶质细胞在氯化血红素(Hemin)刺激下对PKH26标记hUMSC-Exos的摄取增强。
图1J:原代小胶质细胞(pMG)在Hemin刺激后,PKH26标记hUMSC-Exos与Iba1⁺细胞共定位增强。
这些结果表明,hUMSC-Exos具备典型外泌体特征,鼻内递送可高效靶向ICH小鼠血肿周围区域,且能被小胶质细胞、星形胶质细胞和神经元摄取,损伤微环境可促进小胶质细胞对其摄取,为后续治疗作用奠定基础。
2、hUMSC-Exos促进ICH后的神经功能恢复并减少神经元凋亡
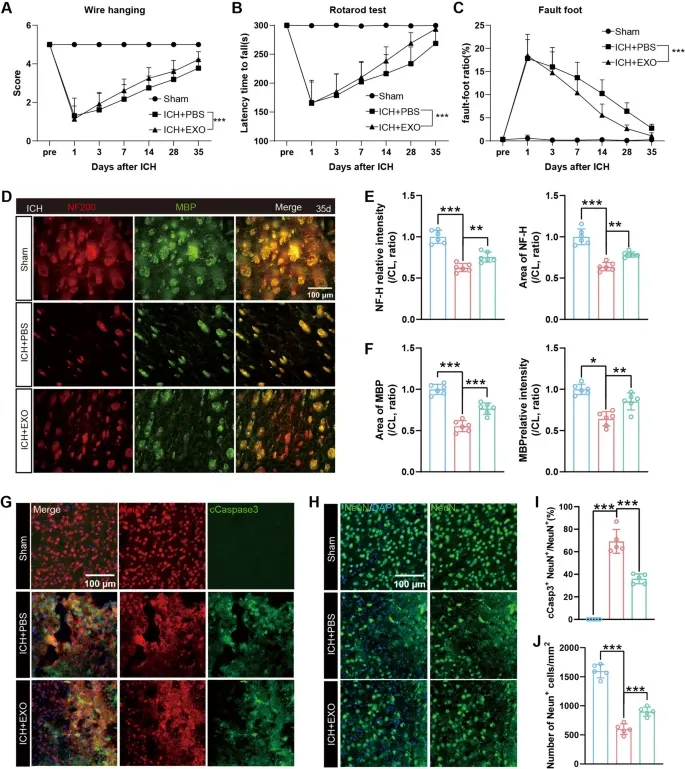
图2A:悬尾实验显示,hUMSC-Exos处理组在ICH后3-35天的运动功能显著优于ICH+PBS组。
图2B:转棒实验显示,hUMSC-Exos处理组的运动协调性和平衡能力在ICH后7-35天显著改善。
图2C:足失误实验显示,hUMSC-Exos处理组的感觉运动缺陷在ICH后7-35天明显缓解。
图2D:免疫荧光显示,ICH后35天,hUMSC-Exos处理组的髓鞘碱性蛋白(MBP)和神经丝-H(NF-H)表达显著高于ICH+PBS组。
图2E:定量分析显示,hUMSC-Exos处理组MBP荧光强度和面积显著增加。
图2F:定量分析显示,hUMSC-Exos处理组NF-H荧光强度和面积显著增加。
图2G:免疫荧光显示,ICH后3天,hUMSC-Exos处理组的Cleaved-caspase3⁺/NeuN⁺凋亡神经元数量显著少于ICH+PBS组。
图2H:免疫荧光显示,ICH后3天,hUMSC-Exos处理组的NeuN⁺神经元密度显著高于ICH+PBS组。
图2I:定量分析显示,hUMSC-Exos处理组凋亡神经元比例显著降低。
图2J:定量分析显示,hUMSC-Exos处理组神经元密度显著升高。
这些结果表明,hUMSC-Exos可改善ICH小鼠的感觉运动功能,保护髓鞘和轴突完整性,通过抑制神经元凋亡发挥急性神经保护作用,同时促进慢性期髓鞘碎片清除。
3、hUMSC-Exos调控小胶质细胞极化并抑制ICH后的神经炎症
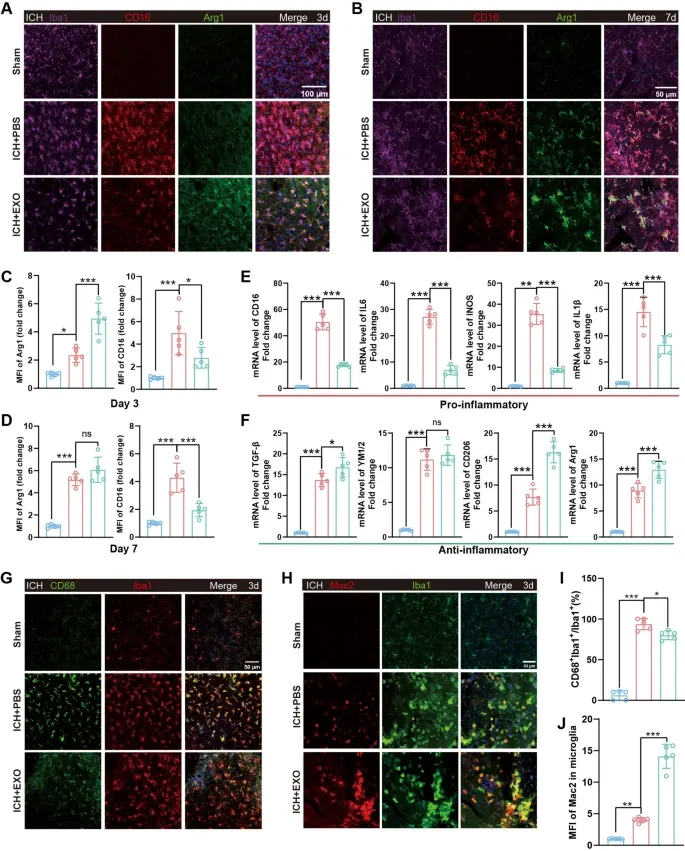
图3A:免疫荧光显示,ICH后3天,hUMSC-Exos处理组Iba1⁺/CD16⁺促炎小胶质细胞数量显著少于ICH+PBS组。
图3B:免疫荧光显示,ICH后7天,hUMSC-Exos处理组Iba1⁺/CD16⁺促炎小胶质细胞数量仍显著低于ICH+PBS组。
图3C:定量分析显示,ICH后3天,hUMSC-Exos处理组促炎小胶质细胞比例显著降低。
图3D:定量分析显示,ICH后7天,hUMSC-Exos处理组抗炎小胶质细胞(Iba1⁺/Arg1⁺)比例显著升高。
图3E:qRT-PCR显示,ICH后3天,hUMSC-Exos处理组CD16、IL6、iNOS、IL1β等促炎基因mRNA水平显著下调。
图3F:qRT-PCR显示,ICH后3天,hUMSC-Exos处理组TGF-β、YM1/2、CD206、Arg1等抗炎基因mRNA水平显著上调。
图3G:免疫荧光显示,ICH后3天,hUMSC-Exos处理组Iba1⁺/CD68⁺吞噬性小胶质细胞数量显著减少。
图3H:免疫荧光显示,ICH后3天,hUMSC-Exos处理组Iba1⁺/Mac2⁺吞噬性小胶质细胞数量显著减少。
图3I:定量分析显示,hUMSC-Exos处理组CD68⁺小胶质细胞比例显著降低。
图3J:定量分析显示,hUMSC-Exos处理组Mac2⁺小胶质细胞比例显著降低。
这些结果表明,hUMSC-Exos可诱导小胶质细胞从促炎表型向抗炎表型极化,下调促炎因子表达、上调抗炎因子表达,同时抑制小胶质细胞过度吞噬活性,从而重塑ICH后的免疫微环境。
4、hUMSC-Exos在体外抑制Hemin诱导的小胶质细胞活化并促进抗炎表型转化
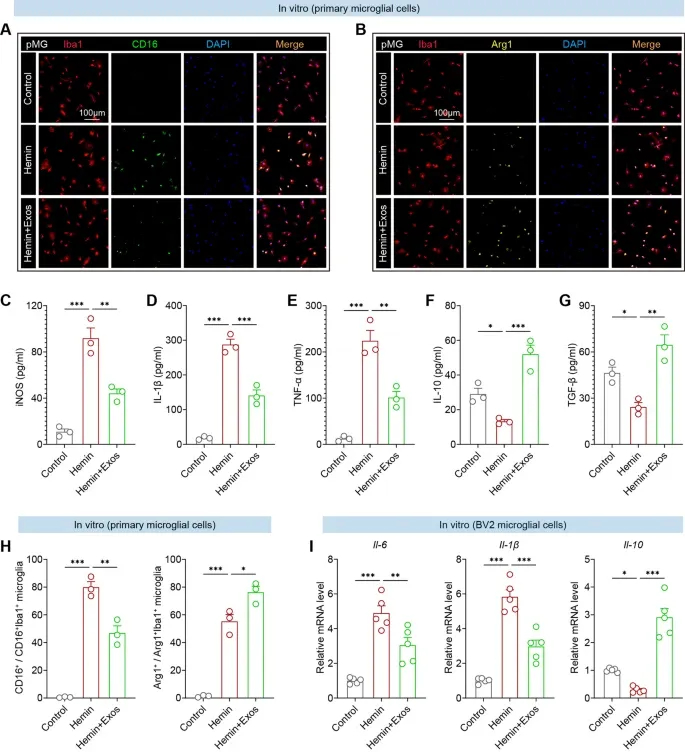
图4A:免疫荧光显示,Hemin刺激后原代小胶质细胞(pMG)中Iba1⁺/CD16⁺促炎细胞增多,hUMSC-Exos处理后显著减少。
图4B:免疫荧光显示,hUMSC-Exos处理后,原代小胶质细胞中Iba1⁺/Arg1⁺抗炎细胞显著增多。
图4C:ELISA显示,hUMSC-Exos处理显著抑制Hemin诱导的iNOS分泌。
图4D:ELISA显示,hUMSC-Exos处理显著抑制Hemin诱导的IL-1β分泌。
图4E:ELISA显示,hUMSC-Exos处理显著抑制Hemin诱导的TNF-α分泌。
图4F:ELISA显示,hUMSC-Exos处理显著上调IL-10分泌。
图4G:ELISA显示,hUMSC-Exos处理显著上调TGF-β分泌。
图4H:定量分析显示,hUMSC-Exos处理显著降低CD16⁺小胶质细胞比例、升高Arg1⁺小胶质细胞比例。
图4I:qRT-PCR显示,BV2细胞中hUMSC-Exos处理下调Il-6、Il-1βmRNA水平,上调Il-10 mRNA水平。
这些结果表明,hUMSC-Exos在体外可直接抑制Hemin诱导的小胶质细胞促炎活化,促进其向抗炎表型转化,调控炎症细胞因子分泌,验证了其细胞自主性抗炎作用。
5、RNA-seq分析揭示hUMSC-Exos重编程小胶质细胞的炎症转录特征
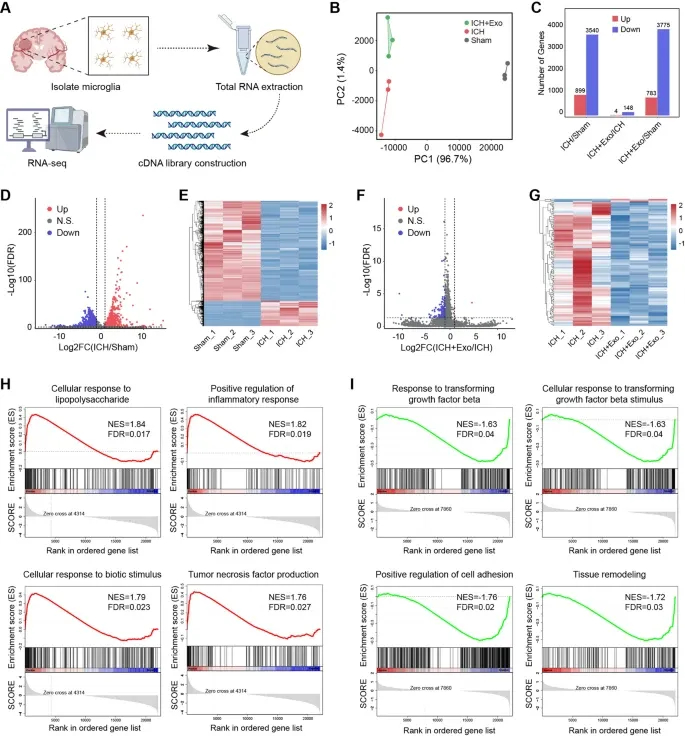
图5A:实验流程示意图,从小鼠脑组织分离小胶质细胞,提取总RNA并构建RNA-seq文库。
图5B:主成分分析(PCA)显示,Sham、ICH、ICH+Exo三组小胶质细胞转录组呈明显聚类分离,ICH+Exo组部分重叠于Sham组。
图5C:柱状图显示,ICH vs Sham组有3540个基因上调、3775个基因下调;ICH+Exo vs ICH组有783个基因上调、14%基因下调。
图5D:火山图显示,ICH vs Sham组差异表达基因(DEGs)分布,红色为上调、蓝色为下调。
图5E:热图显示,ICH vs Sham组炎症相关DEGs的层级聚类表达模式。
图5F:火山图显示,ICH+Exo vs ICH组DEGs分布,部分ICH诱导的基因变化被逆转。
图5G:热图显示,hUMSC-Exos逆转ICH诱导的炎症相关基因表达变化。
图5H:GSEA分析显示,ICH vs Sham组富集LPS应答、炎症反应、TNF产生等促炎通路。
图5I:GSEA分析显示,ICH+Exo vs ICH组富集TGF-β应答、细胞黏附、组织重塑等抗炎修复通路。
这些结果表明,hUMSC-Exos可在全基因组水平重编程小胶质细胞转录组,显著抑制ICH诱导的促炎转录程序,同时激活组织修复相关通路。
6、轨迹分析识别hUMSC-Exos抑制的炎症模块及iNOS⁺小胶质细胞
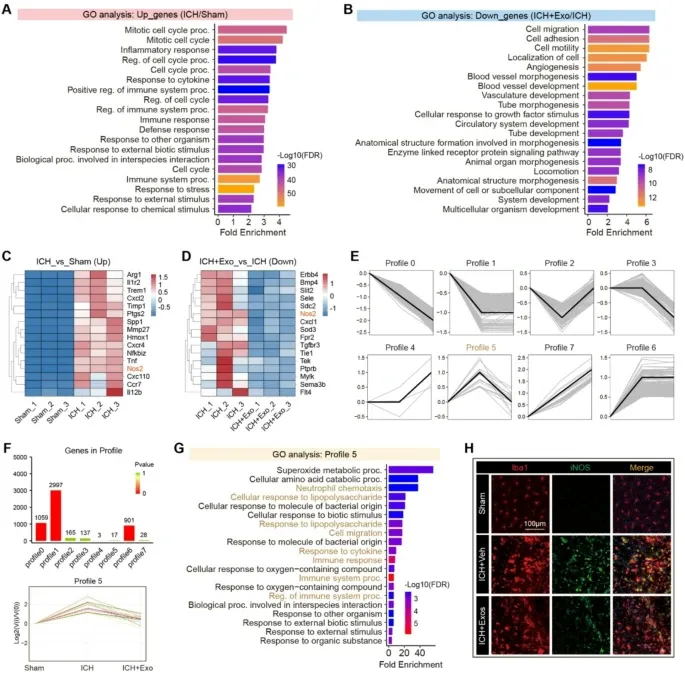
图6A:GO富集分析显示,ICH vs Sham组上调基因富集有丝分裂周期、细胞因子应答、固有免疫激活等通路。
图6B:GO富集分析显示,ICH+Exo vs ICH组下调基因富集细胞迁移、黏附、血管生成等病理重塑通路。
图6C:热图显示,ICH组Tnf、Trem1、Nos2、Ccr7等促炎基因显著上调。
图6D:热图显示,hUMSC-Exos处理后上述促炎基因显著下调。
图6E:时序聚类显示,Sham、ICH、ICH+Exo三组基因表达分为8个不同谱图。
图6F:谱图5基因呈“ICH后上调、Exos处理后下调”趋势,包含17个动态调控基因。
图6G:GO富集分析显示,谱图5基因富集LPS应答、中性粒细胞趋化、超氧化物代谢等炎症通路。
图6H:免疫荧光显示,ICH组Iba1⁺/iNOS⁺小胶质细胞显著增多,hUMSC-Exos处理后显著减少。
这些结果表明,hUMSC-Exos可特异性抑制ICH诱导的核心炎症基因模块,直接靶向iNOS⁺促炎小胶质细胞,阻断氧化应激相关病理过程。
7、SIRT1介导的NF-κB/NOS2信号抑制是hUMSC-Exos抗炎作用的核心机制
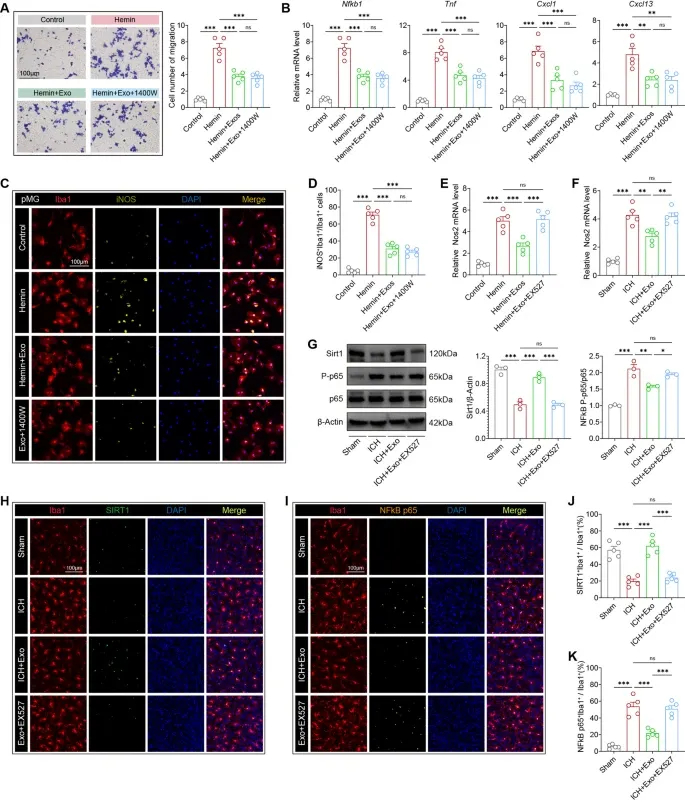
图7A:Transwell迁移实验显示,hUMSC-Exos和NOS2抑制剂1400W均显著抑制Hemin诱导的BV2细胞迁移。
图7B:qRT-PCR显示,hUMSC-Exos与1400W协同下调Nfkb1、Tnf、Cxcl1、Cxcl13等促炎基因表达。
图7C:免疫荧光显示,Hemin诱导原代小胶质细胞iNOS表达,hUMSC-Exos和1400W处理后显著减少。
图7D:定量分析显示,hUMSC-Exos与1400W联合处理对iNOS⁺小胶质细胞的抑制作用更显著。
图7E:qRT-PCR显示,SIRT1抑制剂EX527可逆转hUMSC-Exos对NOS2 mRNA的下调作用。
图7F:体内检测显示,EX527可逆转hUMSC-Exos对ICH小鼠脑组织NOS2的抑制作用。
图7G:Western blot显示,hUMSC-Exos上调ICH小鼠脑组织SIRT1蛋白水平,下调p-p65/p65比值,EX527可逆转该效应。
图7H:免疫荧光显示,hUMSC-Exos处理组Iba1⁺/SIRT1⁺小胶质细胞比例显著升高,EX527可逆转。
图7I:免疫荧光显示,hUMSC-Exos处理组Iba1⁺/NF-κBp65⁺小胶质细胞比例显著降低,EX527可逆转。
图7J:定量分析显示,hUMSC-Exos显著升高SIRT1⁺/Iba1⁺细胞比例,EX527可阻断。
图7K:定量分析显示,hUMSC-Exos显著降低NF-κB p65⁺/Iba1⁺细胞比例,EX527可阻断。
这些结果表明,hUMSC-Exos通过上调SIRT1,抑制NF-κB核转位及下游NOS2表达,形成SIRT1-NF-κB-NOS2调控轴,这是其发挥抗炎作用的核心分子机制。
8、SIRT1是hUMSC-Exos调控微胶质细胞增殖、神经元凋亡及行为学恢复的必需分子
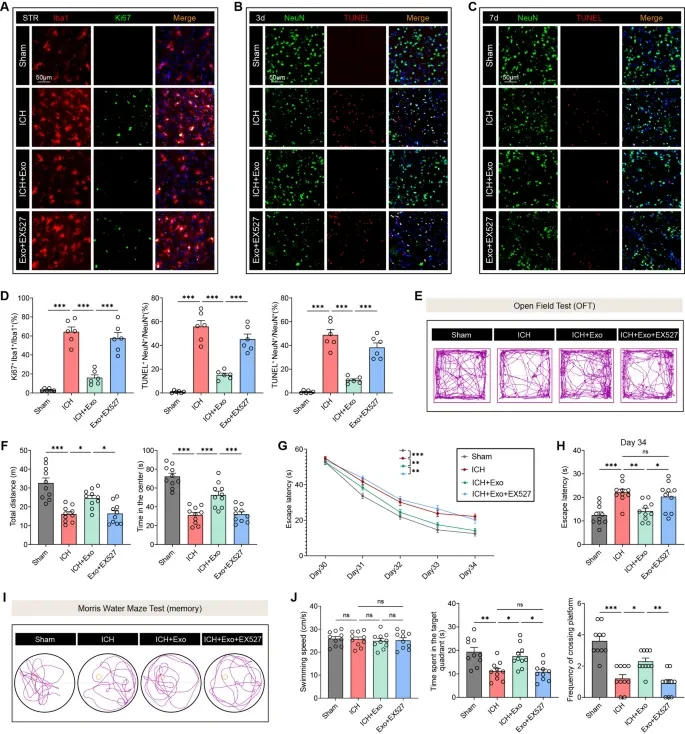
图8A:免疫荧光显示,ICH组Ki67⁺/Iba1⁺增殖小胶质细胞增多,hUMSC-Exos处理后减少,EX527可逆转。
图8B:TUNEL染色显示,ICH后3天NeuN⁺/TUNEL⁺凋亡神经元增多,hUMSC-Exos处理后减少,EX527可逆转。
图8C:TUNEL染色显示,ICH后7天凋亡神经元仍增多,hUMSC-Exos的抗凋亡作用可被EX527阻断。
图8D:定量分析显示,hUMSC-Exos显著降低Ki67⁺/Iba1⁺细胞和凋亡神经元数量,EX527可完全逆转。
图8E:旷场实验显示,hUMSC-Exos处理组小鼠运动轨迹更广泛,EX527可逆转。
图8F:定量分析显示,hUMSC-Exos显著增加总运动距离和中央区域停留时间,EX527可阻断。
图8G:Morris水迷宫显示,hUMSC-Exos处理组逃避潜伏期逐渐缩短,EX527可逆转。
图8H:第34天逃避潜伏期定量显示,hUMSC-Exos组显著缩短,EX527组与ICH组无差异。
图8I:探针实验显示,hUMSC-Exos组游泳路径更集中于目标象限,EX527可逆转。
图8J:定量分析显示,hUMSC-Exos显著增加目标象限停留时间和平台穿越次数,EX527可阻断。
这些结果表明,SIRT1是hUMSC-Exos发挥微胶质细胞增殖抑制、神经元凋亡保护及感觉运动/认知功能恢复作用的必需分子,验证了SIRT1依赖的治疗机制。
结论
本研究证实,人脐带间充质干细胞来源外泌体(hUMSC-Exos)经鼻内递送可高效靶向脑出血(ICH)小鼠血肿周围组织,被小胶质细胞、星形胶质细胞和神经元摄取;其通过上调SIRT1,抑制NF-κB核转位及下游NOS2表达,诱导小胶质细胞从促炎表型向抗炎表型转化,减少促炎因子分泌,同时抑制小胶质细胞过度增殖与吞噬,减轻神经元凋亡,保护髓鞘和轴突完整性,最终改善ICH小鼠的感觉运动和认知功能;SIRT1抑制剂EX527可完全阻断hUMSC-Exos的上述有益效应,而NOS2抑制剂可模拟其神经保护作用。这些发现揭示了hUMSC-Exos通过SIRT1-NF-κB/NOS2轴调控小胶质细胞稳态的核心机制,确立了其作为ICH无细胞治疗策略的潜力,为急性脑损伤的精准治疗提供了新的科学依据。






