研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Cell Discov】12+,细胞界“预警漏洞”!细菌毒素诱导迁移体释放,竟是炎症“幕后黑手”~
24 人阅读发布时间:2025-12-04 14:23
该研究围绕“细菌毒素如何触发宿主急性炎症”这一核心问题,采用“现象发现—机制解析—体内验证—功能确认”的递进式研究思路:首先观察艰难梭菌毒素B3(TcdB3)对体外培养细胞的影响,发现其诱导迁移体形成的特殊现象;通过筛选不同细菌毒素和效应蛋白,明确非经典迁移胞吐的诱导特异性;借助基因敲低、药物抑制等技术,揭示RhoGTP酶、微管及SMS2在该过程中的调控作用;在小鼠体内验证毒素诱导的迁移体形成及主要靶细胞;最后利用迁移胞吐缺陷型(Tspan9⁻/⁻)小鼠,证实非经典迁移胞吐在毒素诱导急性炎症中的关键作用,完整阐明“细菌毒素—非经典迁移胞吐—炎症因子释放—急性炎症加重”的调控路径。

研究背景
大型梭菌毒素(LCTs)等细菌毒素可通过修饰Rho/Ras家族小GTP酶,破坏宿主细胞肌动蛋白细胞骨架,引发细胞病变和急性炎症,但具体调控机制尚未完全明确。
迁移胞吐是迁移细胞通过释放迁移体介导胞内成分释放的过程,参与细胞间通讯、线粒体稳态等生理功能,其发生依赖细胞迁移和四跨膜蛋白(TSPANs)等分子。但迁移胞吐是否可在非迁移细胞中发生、是否参与病原体诱导的炎症反应,以及细菌毒素能否调控该过程,均为尚未解决的研究缺口。此外,宿主如何通过迁移胞吐感知病原体侵袭并启动炎症应答,相关分子机制仍需深入探究。
研究结果
1、艰难梭菌TcdB3诱导培养细胞形成迁移体
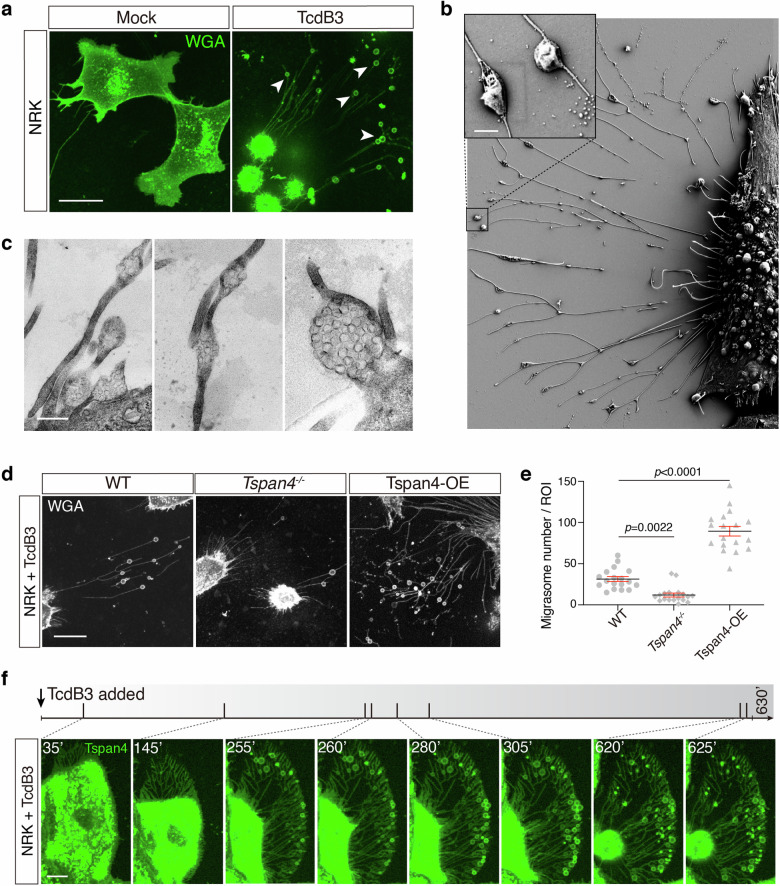
TcdB3处理后,NRK、U2OS等多种细胞会从收缩的细胞体延伸出细丝,并在细丝上形成大量囊泡结构(图1a);SEM和TEM证实这些囊泡直径200nm-1μm,内部含多个小颗粒,符合迁移体的形态特征(图1b、c);蛋白质组学检测到囊泡中富集TSPAN家族蛋白、PigK等迁移体标志物,且Tspan4过表达细胞的迁移体数量显著增加,Tspan4敲除细胞迁移体形成能力显著下降(图1d、e);实时活细胞成像显示,毒素诱导的迁移体在形成后数分钟至6小时内破裂释放内容物(图1f)。这些结果表明,艰难梭菌TcdB3可在体外培养细胞中诱导非经典迁移胞吐,且TSPAN4对该过程有促进作用。
2、迁移胞吐具有细菌毒素和效应蛋白选择性
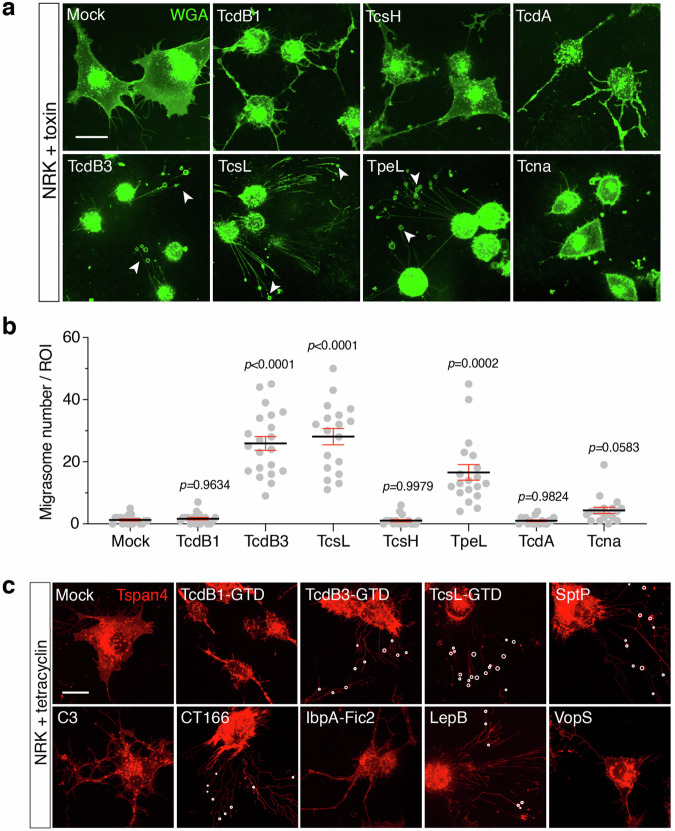
在多种LCTs中,仅TcdB3、TcsL和TpeL能有效诱导迁移体形成,而TcdB1、TcdA等其他毒素无法诱导(图2a、b);表达TcdB3和TcsL的糖基转移酶结构域(GTD),或沙门氏菌SptP、衣原体CT166等靶向Rho/Ras家族的细菌效应蛋白,均能诱导迁移体形成,而无GTD活性的TcdB3突变体则无此效应(图2c)。这些结果表明,迁移胞吐的诱导具有特异性,仅靶向小GTP酶的特定细菌毒素及其效应蛋白可触发该过程,且依赖其酶活性而非进入细胞的途径。
3、RhoGTP酶活性和微管稳定性对迁移体形成至关重要
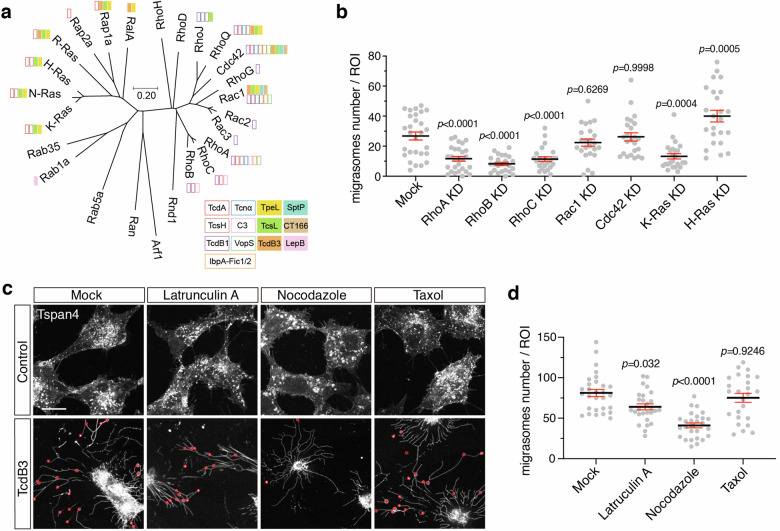
系统发育分析表明诱导迁移胞吐的毒素/效应蛋白均不靶向RhoA/B/C,但敲低RhoA、RhoB、RhoC会显著减少迁移体数量,敲低Rac1、Cdc42则无明显影响(图3a、b);微管解聚剂诺考达唑可显著抑制TcdB3诱导的迁移体形成,而肌动蛋白解聚剂拉春库林A和微管稳定剂紫杉醇无明显作用(图3c、d);SMS2抑制剂Ly93和SMS-IN-1也能阻断该过程,而PIP2抑制剂无影响。这些结果表明,RhoGTP酶活性、微管稳定性及SMS2功能是毒素诱导非经典迁移胞吐的必需条件。
4、细菌毒素在体内诱导迁移体形成
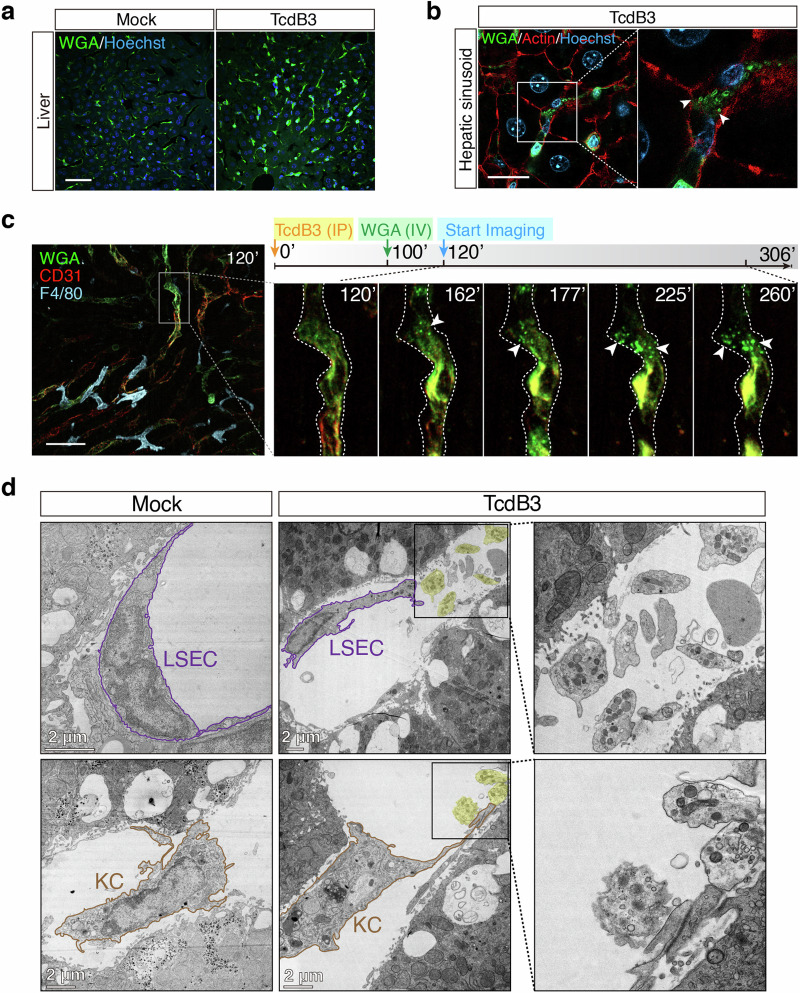
TcdB3腹腔注射小鼠后,肝脏组织的WGA阳性信号显著增强(图4a);超高分辨率共聚焦显微镜在肝血窦区域检测到直径约1μm的类迁移体结构(图4b);活体成像显示,肝血窦内皮细胞(LSECs)在毒素刺激后会产生WGA阳性迁移体(图4c);TEM证实,毒素处理后LSECs和枯否细胞(KCs)周围出现含小囊泡和线粒体的迁移体结构(图4d);分离的原代LSECs和骨髓来源巨噬细胞对TcdB3敏感,体外处理后可形成迁移体。这些结果表明,细菌毒素可在小鼠体内诱导迁移体形成,LSECs和KCs是体内主要的靶细胞。
5、迁移胞吐缺陷型小鼠对TcdB3耐受,炎症反应减弱
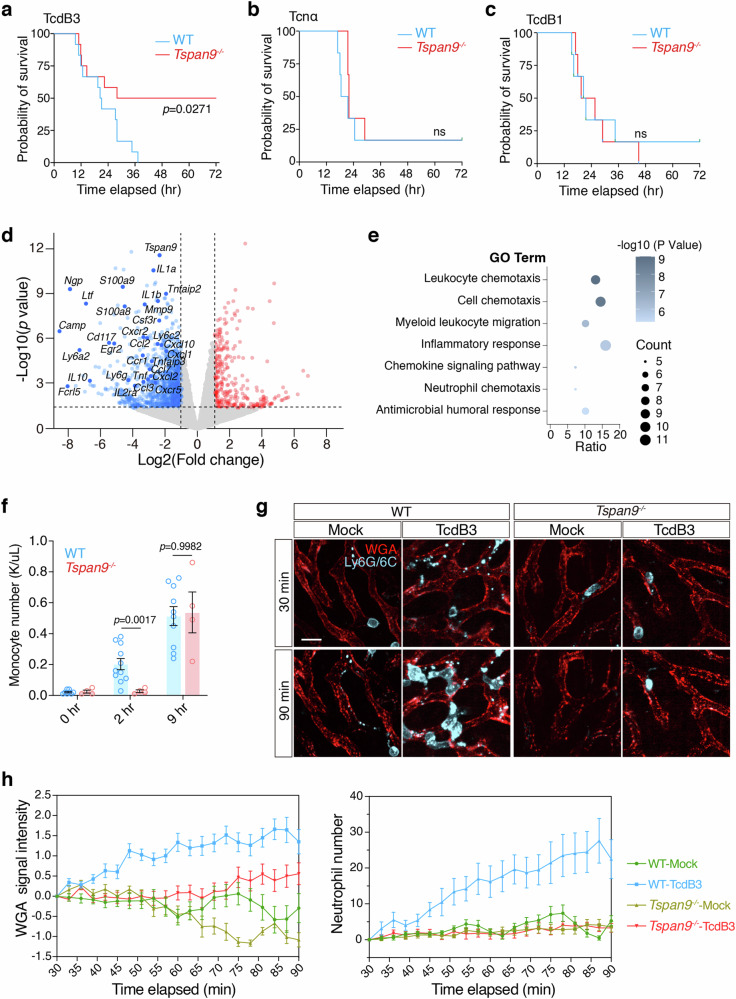
Tspan9⁻/⁻小鼠在TcdB3攻击后存活率约50%,而野生型小鼠全部在36小时内死亡,且两者对不诱导迁移胞吐的Tcnα和TcdB1敏感性无差异(图5a、b、c);转录组分析显示,TcdB3处理后,Tspan9⁻/⁻小鼠肝脏中趋化因子、炎症因子相关基因(如Cxcl10、Tnf)表达显著低于野生型(图5d、e);血液检测和活体成像显示,野生型小鼠在毒素处理后2小时单核细胞数量显著升高,90分钟内肝脏出现大量中性粒细胞浸润,而Tspan9⁻/⁻小鼠的免疫细胞浸润明显延迟且减弱(图5f、g、h)。这些结果表明,迁移胞吐缺陷会降低小鼠对TcdB3的敏感性,减轻毒素诱导的急性炎症反应,证实非经典迁移胞吐在毒素介导的败血症中起关键作用。
结论
本研究首次发现,靶向小GTP酶的细菌毒素及其效应蛋白可诱导非经典迁移胞吐,该过程不依赖细胞迁移,在迁移和非迁移细胞中均能发生。机制上,非经典迁移胞吐依赖RhoGTP酶活性、微管稳定性及SMS2功能,且TSPAN家族蛋白参与调控。体内实验证实,艰难梭菌TcdB3可在小鼠肝脏的LSECs和KCs中诱导迁移体形成,迁移体通过释放炎症因子等内容物,加重早期炎症反应并促进免疫细胞浸润,最终加剧毒素介导的败血症。
研究不仅拓展了迁移胞吐的生物学功能,揭示了其作为宿主感知病原体侵袭、启动炎症应答的新型机制,还明确了非经典迁移胞吐在细菌毒素诱导急性炎症中的关键作用。这些发现为理解病原体-宿主相互作用提供了新视角,同时为细菌毒素介导的炎症相关疾病提供了潜在治疗靶点(如靶向TSPAN家族蛋白或SMS2)。






