研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
科研选题新思路!tLyp-1修饰外泌体介导ASO递送+ ceRNA网络,肺腺相关干预研究创新点直接学~
28 人阅读发布时间:2025-12-10 16:27
肺腺癌(LUAD)作为非小细胞肺癌的主要亚型,发病率和死亡率居高不下,转移是导致患者预后不佳的关键因素。环状RNA(circRNA)circRAPGEF5在LUAD中高表达,可促进肿瘤增殖和转移,是潜在治疗靶点,但如何高效、安全地将核酸药物递送至肿瘤细胞仍是临床难题。外泌体凭借低免疫原性、高生物相容性和载药能力,成为理想的核酸递送载体,而未修饰外泌体的脱靶效应限制了其应用。tLyp-1肽可特异性结合肿瘤细胞高表达的neuropilin-1(NRP1)和neuropilin-2(NRP2),实现肿瘤靶向递送。

今天分享的是发表在【Mater Today Bio】(IF:10.2)上题为“TLyp-1-modified exosome-mediated delivery of circRAPGEF5 ASO inhibits lung adenocarcinoma metastasis via regulating the miR-570-3p/SPP1 axis”的研究。该研究构建tLyp-1修饰的外泌体(tLyp-1-EXO),负载circRAPGEF5反义寡核苷酸(circRAPGEF5 ASO),探究其对LUAD转移的抑制作用及分子机制,为LUAD的靶向治疗提供新策略。
研究结果
1、tLyp-1-EXO-circRAPGEF5 ASO的构建与表征
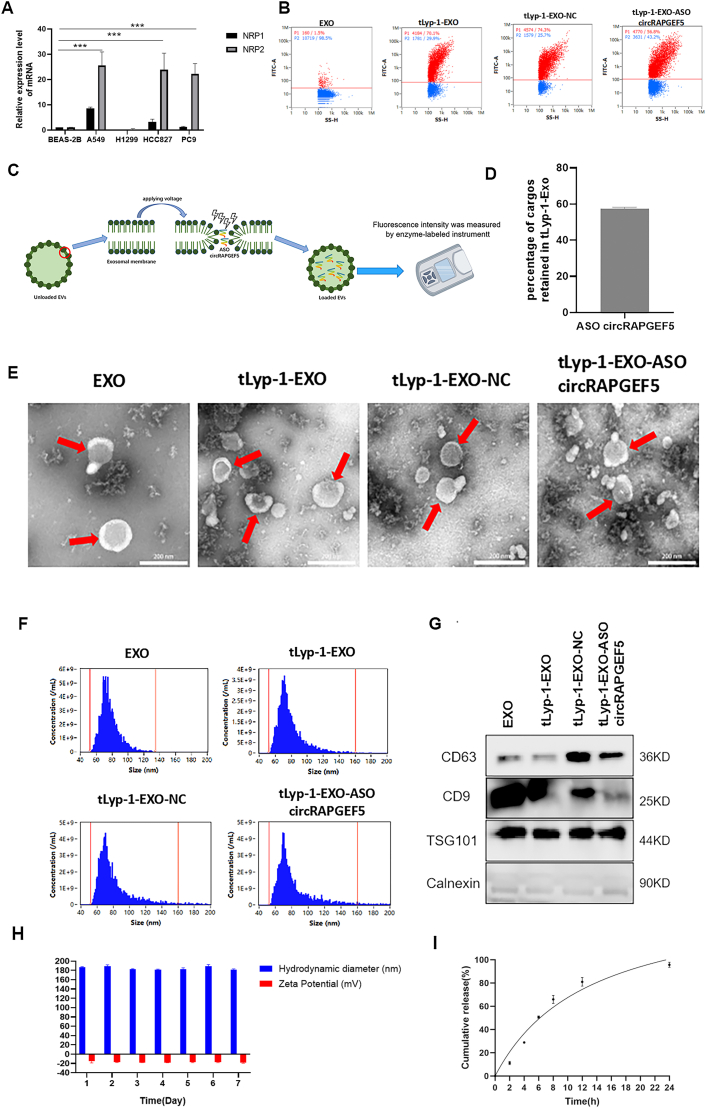
图1A:RT-qPCR检测显示,与正常肺上皮细胞BEAS-2B相比,A549、H1299、HCC827、PC9等LUAD细胞中NRP1和NRP2表达均上调。
图1B:纳米流式检测器验证,tLyp-1肽通过链霉亲和素-生物素系统成功连接至外泌体表面,HA标签检测呈阳性。
图1C:Cy3标记的circRAPGEF5 ASO成功负载至tLyp-1修饰外泌体中,可观察到红色荧光信号。
图1D:多功能酶标仪检测显示,circRAPGEF5 ASO的负载效率约为60%。
图1E:TEM观察显示,EXO、tLyp-1-EXO、tLyp-1-EXO-NC、tLyp-1-EXO-circRAPGEF5 ASO均呈典型双层盘状形态。
图1F:纳米流式分析显示,修饰前后外泌体粒径分布在52-160nm之间,平均粒径为52-134.5nm。
图1G:Western blot验证,四种外泌体均表达CD63、CD9、TSG101等外泌体标志物,几乎不表达内质网标志物calnexin。
图1H:动态光散射(DLS)检测显示,tLyp-1-EXO-circRAPGEF5 ASO在PBS中连续7天粒径稳定在181-189.1nm,zeta电位从-15.1mV轻微降至-17.9mV。
图1I:药物释放曲线显示,tLyp-1-EXO-circRAPGEF5 ASO在PBS中2小时释放率为11%,24小时释放率达95%。
这些结果表明,tLyp-1修饰和circRAPGEF5 ASO负载未改变外泌体的基本形态和标志物表达,构建的tLyp-1-EXO-circRAPGEF5 ASO具有良好的稳定性和药物缓释能力,符合核酸递送载体的要求。
2、tLyp-1-EXO-circRAPGEF5 ASO的体内外靶向性与载体递送
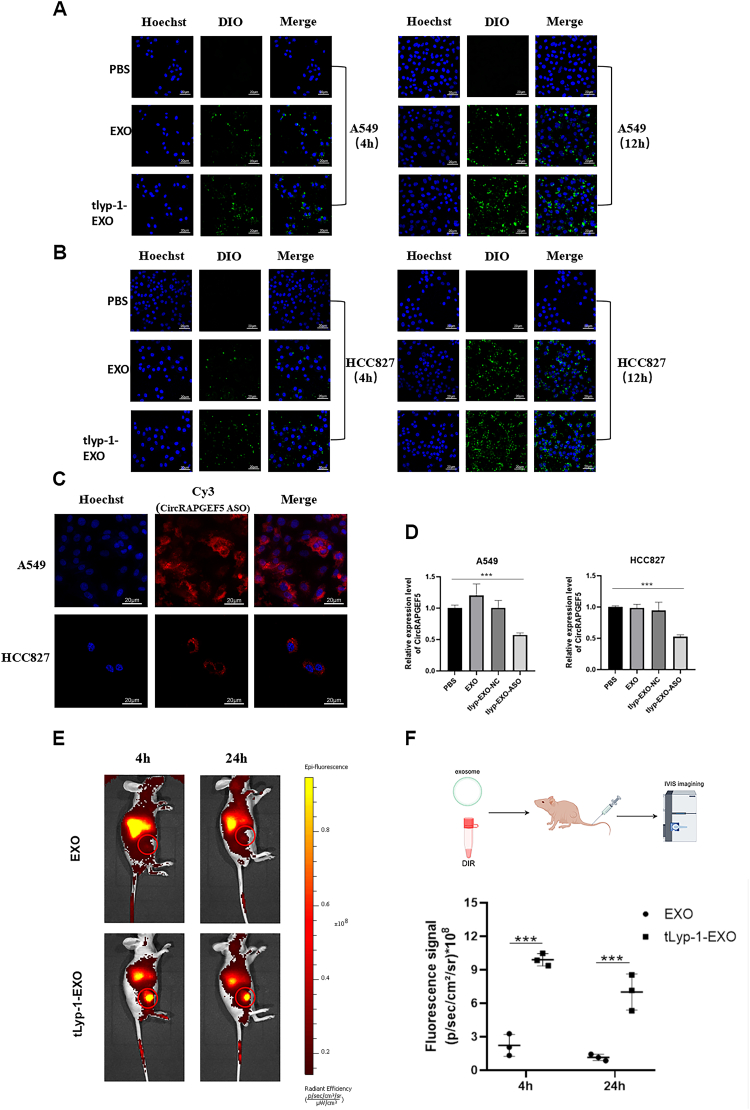
图2A:共聚焦荧光成像显示,DiO标记的tLyp-1-EXO与A549细胞共培养4小时和12小时后,绿色荧光强度显著高于未修饰EXO组。
图2B:共聚焦荧光成像显示,tLyp-1-EXO与HCC827细胞共培养后,细胞内荧光强度明显高于EXO组。
图2C:共聚焦荧光成像显示,Cy3标记的circRAPGEF5 ASO可通过tLyp-1-EXO成功递送至细胞内,红色荧光与细胞核蓝色荧光共定位。
图2D:RT-qPCR检测显示,tLyp-1-EXO-circRAPGEF5 ASO处理组A549和HCC827细胞中circRAPGEF5表达水平显著低于PBS、EXO和tLyp-1-EXO-NC组。
图2E:IVIS成像显示,尾静脉注射DiR标记的tLyp-1-EXO后,4小时和24小时肿瘤部位荧光强度显著高于未修饰EXO组。
图2F:荧光强度定量显示,tLyp-1-EXO在肿瘤部位的富集量显著高于EXO组,且24小时仍保持较高荧光信号。
这些结果表明,tLyp-1修饰可显著增强外泌体对LUAD细胞的体外靶向结合与内化能力,实现circRAPGEF5 ASO的高效递送并下调靶基因表达,同时在体内具有良好的肿瘤靶向性和滞留能力。
3、tLyp-1-EXO-circRAPGEF5 ASO的体外抗肿瘤效应
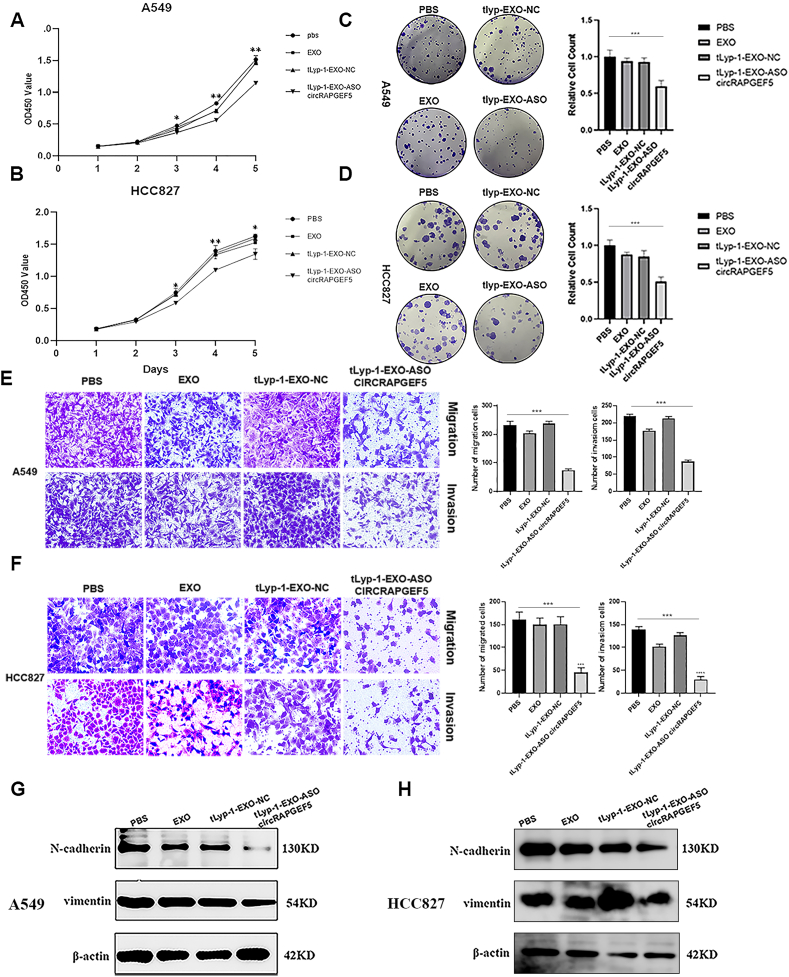
图3A:CCK-8实验显示,tLyp-1-EXO-circRAPGEF5 ASO处理后,A549细胞增殖活性显著低于PBS、EXO和tLyp-1-EXO-NC组。
图3B:CCK-8实验显示,HCC827细胞增殖活性在tLyp-1-EXO-circRAPGEF5 ASO处理后显著降低。
图3C:克隆形成实验显示,tLyp-1-EXO-circRAPGEF5 ASO组A549细胞形成的克隆数显著少于其他三组。
图3D:克隆形成实验显示,HCC827细胞克隆形成能力在tLyp-1-EXO-circRAPGEF5 ASO处理后显著下降。
图3E:Transwell实验显示,tLyp-1-EXO-circRAPGEF5 ASO显著减少A549细胞的迁移和侵袭数量。
图3F:Transwell实验显示,HCC827细胞的迁移和侵袭能力在tLyp-1-EXO-circRAPGEF5 ASO处理后显著受抑。
图3G:Western blot显示,tLyp-1-EXO-circRAPGEF5 ASO处理后,A549细胞中EMT标志物N-cadherin和vimentin表达显著下调。
图3H:Western blot显示,HCC827细胞中N-cadherin和vimentin蛋白水平在tLyp-1-EXO-circRAPGEF5 ASO处理后显著降低。
这些结果表明,tLyp-1-EXO-circRAPGEF5 ASO在体外可显著抑制LUAD细胞的增殖、克隆形成、迁移和侵袭能力,并下调EMT相关标志物表达,发挥抗肿瘤效应。
4、circRAPGEF5作为miR-570-3p海绵促进LUAD进展
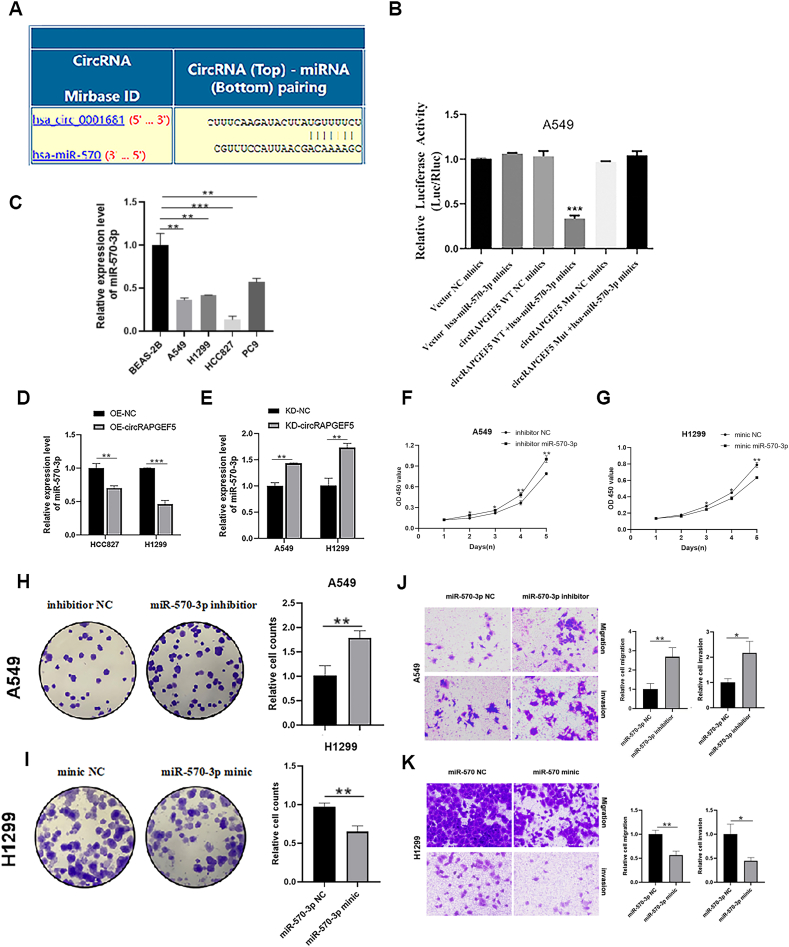
图4A:Circular RNA Interactome预测显示,circRAPGEF5与miR-570-3p存在潜在结合位点。
图4B:双荧光素酶报告实验显示,共转染circRAPGEF5 WT和miR-570-3p mimic后,A549细胞的荧光素酶活性显著降低,突变体组无明显变化。
图4C:RT-qPCR检测显示,miR-570-3p在LUAD细胞中的表达水平显著低于正常BEAS-2B细胞。
图4D:RT-qPCR显示,circRAPGEF5过表达后,LUAD细胞中miR-570-3p表达显著下调。
图4E:RT-qPCR显示,circRAPGEF5敲低后,LUAD细胞中miR-570-3p表达显著升高。
图4F:CCK-8实验显示,转染miR-570-3p inhibitor后,A549细胞增殖活性显著增强。
图4G:CCK-8实验显示,转染miR-570-3p mimic后,H1299细胞增殖活性显著降低。
图4H:克隆形成实验显示,miR-570-3p inhibitor处理后,A549细胞克隆形成能力增强。
图4I:克隆形成实验显示,miR-570-3p mimic处理后,H1299细胞克隆数显著减少。
图4J:Transwell实验显示,miR-570-3p inhibitor促进A549细胞迁移和侵袭。
图4K:Transwell实验显示,miR-570-3p mimic抑制H1299细胞迁移和侵袭。
这些结果表明,circRAPGEF5可作为miR-570-3p的分子海绵,下调其表达,而miR-570-3p本身具有抑制LUAD细胞增殖、迁移和侵袭的功能,circRAPGEF5通过吸附miR-570-3p促进肿瘤进展。
5、miR-570-3p逆转circRAPGEF5的促肿瘤效应
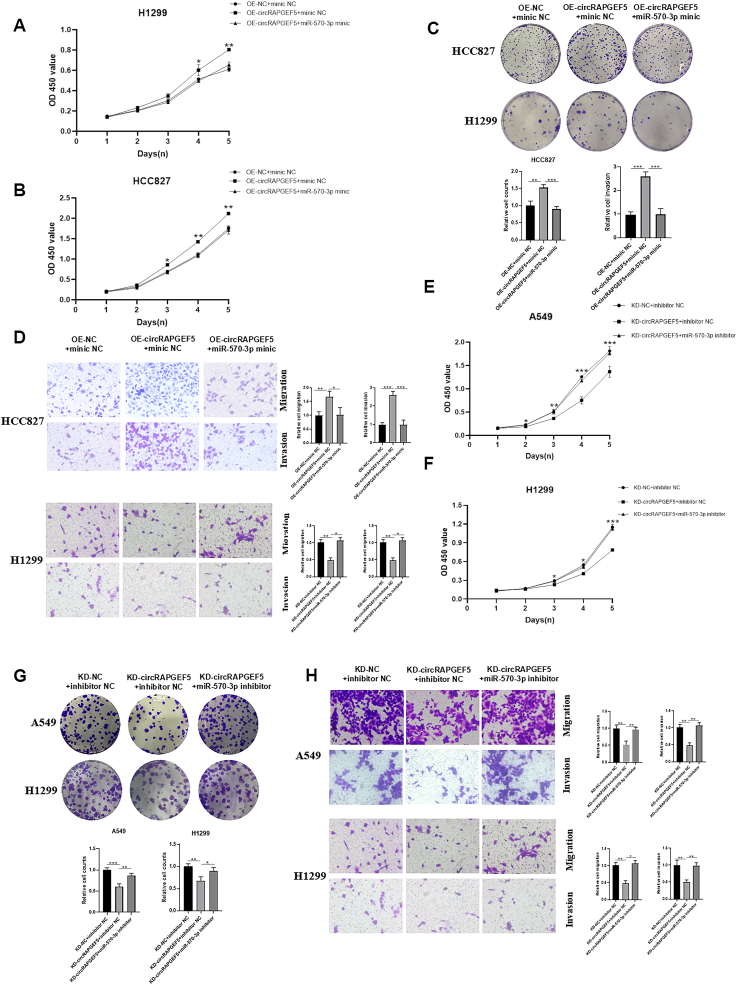
图5A:CCK-8实验显示,共转染OE-circRAPGEF5和miR-570-3p mimic后,HCC827细胞增殖活性显著低于OE-circRAPGEF5+ mimic NC组。
图5B:CCK-8实验显示,miR-570-3p mimic可逆转OE-circRAPGEF5对H1299细胞的促增殖作用。
图5C:克隆形成实验显示,miR-570-3p mimic显著抑制OE-circRAPGEF5诱导的HCC827和H1299细胞克隆形成。
图5D:Transwell实验显示,miR-570-3p mimic可逆转OE-circRAPGEF5促进HCC827和H1299细胞迁移和侵袭的效应。
图5E:CCK-8实验显示,共转染KD-circRAPGEF5和miR-570-3p inhibitor后,A549细胞增殖活性高于KD-circRAPGEF5+inhibitor NC组。
图5F:CCK-8实验显示,miR-570-3p inhibitor可逆转KD-circRAPGEF5对H1299细胞增殖的抑制作用。
图5G:克隆形成实验显示,miR-570-3p inhibitor恢复了KD-circRAPGEF5处理后A549和H1299细胞的克隆形成能力。
图5H:Transwell实验显示,miR-570-3p inhibitor逆转了KD-circRAPGEF5对A549和H1299细胞迁移和侵袭的抑制作用。
这些结果表明,miR-570-3p是circRAPGEF5促LUAD进展的关键下游分子,可直接逆转circRAPGEF5的肿瘤促进效应,进一步验证了二者的相互作用。
6、miR-570-3p直接调控SPP1表达,circRAPGEF5通过miR-570-3p/SPP1轴促进LUAD进展
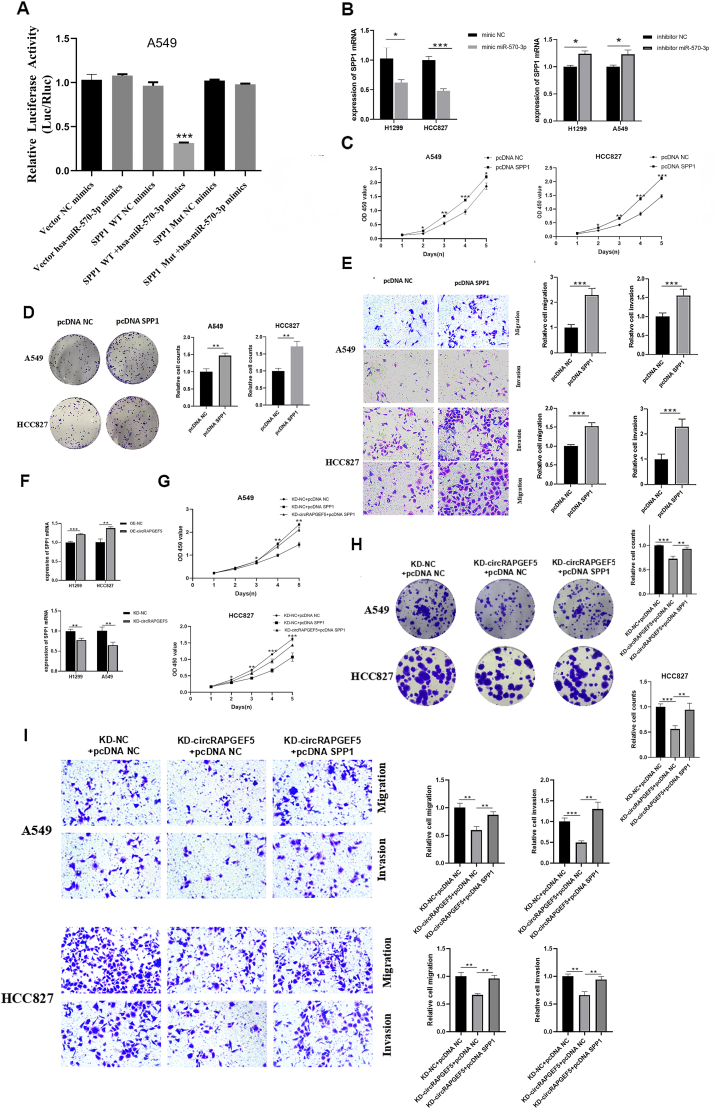
图6A:双荧光素酶报告实验显示,共转染miR-570-3p mimic和SPP1 3'UTR WT后,LUAD细胞荧光素酶活性显著降低,突变体组无明显变化。
图6B:RT-qPCR显示,miR-570-3p mimic处理后SPP1表达显著下调,miR-570-3p inhibitor处理后SPP1表达显著上调。
图6C:CCK-8实验显示,SPP1过表达后,A549和HCC827细胞增殖活性显著增强。
图6D:克隆形成实验显示,SPP1过表达促进A549和HCC827细胞克隆形成。
图6E:Transwell实验显示,SPP1过表达显著增强A549和HCC827细胞的迁移和侵袭能力。
图6F:RT-qPCR显示,circRAPGEF5过表达后SPP1表达上调,circRAPGEF5敲低后SPP1表达下调。
图6G:CCK-8实验显示,共转染KD-circRAPGEF5和pcDNA-SPP1后,A549和HCC827细胞增殖活性高于KD-circRAPGEF5+pcDNA-NC组。
图6H:克隆形成实验显示,SPP1过表达可逆转KD-circRAPGEF5对A549和HCC827细胞克隆形成的抑制作用。
图6I:Transwell实验显示,SPP1过表达恢复了KD-circRAPGEF5处理后A549和HCC827细胞的迁移和侵袭能力。
这些结果表明,SPP1是miR-570-3p的直接靶基因,circRAPGEF5通过吸附miR-570-3p解除其对SPP1的抑制,进而促进LUAD细胞增殖、迁移和侵袭,即circRAPGEF5/miR-570-3p/SPP1轴调控LUAD进展。
7、tLyp-1-EXO-circRAPGEF5 ASO调控miR-570-3p/SPP1轴
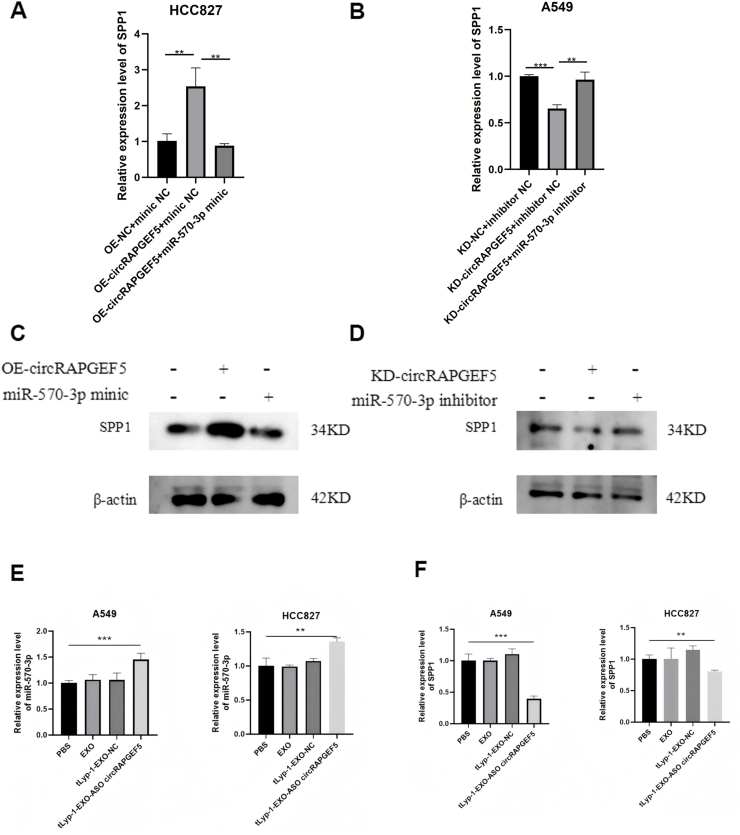
图7A:RT-qPCR显示,共转染OE-circRAPGEF5和miR-570-3p mimic后,HCC827细胞中SPP1表达显著低于OE-circRAPGEF5+mimic NC组。
图7B:RT-qPCR显示,共转染KD-circRAPGEF5和miR-570-3p inhibitor后,A549细胞中SPP1表达高于KD-circRAPGEF5+inhibitor NC组。
图7C:Western blot显示,miR-570-3p mimic可下调OE-circRAPGEF5诱导的HCC827细胞SPP1蛋白表达。
图7D:Western blot显示,miR-570-3p inhibitor可上调KD-circRAPGEF5抑制的A549细胞SPP1蛋白表达。
图7E:RT-qPCR显示,tLyp-1-EXO-circRAPGEF5 ASO处理后,A549和HCC827细胞中miR-570-3p表达显著上调。
图7F:RT-qPCR显示,tLyp-1-EXO-circRAPGEF5 ASO处理后,A549和HCC827细胞中SPP1表达显著下调。
这些结果表明,tLyp-1-EXO-circRAPGEF5 ASO可通过敲低circRAPGEF5,解除其对miR-570-3p的吸附,进而下调SPP1表达,调控miR-570-3p/SPP1轴发挥作用。
8、tLyp-1-EXO-circRAPGEF5 ASO的体内抗肿瘤转移效应及生物安全性
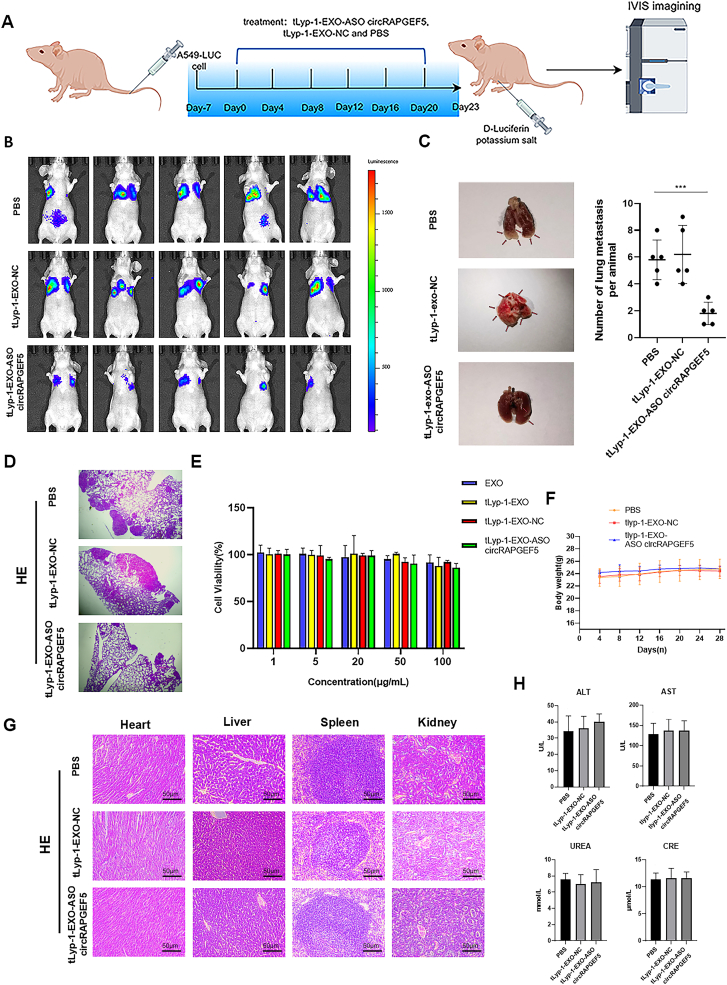
图8A:体内转移模型构建与治疗流程:尾静脉注射A549-LUC细胞1周后,每4天尾静脉注射tLyp-1-EXO-circRAPGEF5 ASO、tLyp-1-EXO-NC或PBS,共6次,期间监测肿瘤生长。
图8B:IVIS成像显示,tLyp-1-EXO-circRAPGEF5 ASO组裸鼠肺部荧光信号显著弱于PBS和tLyp-1-EXO-NC组,表明肿瘤转移受到抑制。
图8C:裸鼠肺部组织观察显示,tLyp-1-EXO-circRAPGEF5 ASO组肺转移结节数量显著少于其他两组。
图8D:HE染色显示,tLyp-1-EXO-circRAPGEF5 ASO组肺部肿瘤组织浸润范围显著小于PBS和tLyp-1-EXO-NC组。
图8E:CCK-8实验显示,不同浓度(1、5、20、50、100μg/mL)的tLyp-1-EXO-circRAPGEF5 ASO与BEAS-2B细胞共培养24小时后,细胞活力无显著变化。
图8F:裸鼠体重监测显示,治疗期间各组裸鼠体重无明显差异,未出现体重下降。
图8G:HE染色显示,各组裸鼠心脏、肝脏、脾脏、肾脏组织无明显结构损伤。
图8H:血清生化检测显示,tLyp-1-EXO-circRAPGEF5 ASO组裸鼠ALT、AST、UREA、CRE水平与PBS组无显著差异,无明显肝肾功能毒性。
这些结果表明,tLyp-1-EXO-circRAPGEF5 ASO在体内可显著抑制LUAD转移,且对正常细胞和裸鼠主要脏器无明显毒性,生物安全性良好。
结论
本研究成功构建了tLyp-1修饰的外泌体递送系统tLyp-1-EXO-circRAPGEF5 ASO,该系统通过tLyp-1肽与LUAD细胞高表达的NRP1/2结合,实现肿瘤靶向递送,高效敲低circRAPGEF5表达;分子机制上,circRAPGEF5作为miR-570-3p的分子海绵,其敲低可释放miR-570-3p,进而抑制靶基因SPP1表达,通过circRAPGEF5/miR-570-3p/SPP1轴抑制LUAD细胞增殖、迁移、侵袭及上皮间质转化;体内实验证实该递送系统可显著抑制LUAD转移,且无明显生物毒性。该研究为LUAD的靶向治疗提供了新型高效的核酸递送载体和潜在治疗靶点,具有重要临床转化价值。






