研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
“植物外泌体”重磅!西兰花外泌体复合水凝胶重塑免疫微环境,解锁耐药菌感染伤口抗瘢痕愈合新策略!
24 人阅读发布时间:2025-12-11 14:30
近年来,外泌体因其固有的跨细胞信号传导能力而成为调节伤口愈合的有前景的治疗剂。但动物来源的外泌体存在病原体污染、成本高、免疫排斥等问题。而植物来源的外泌体低免疫原性、可大规模生产且能跨物种调节,如生姜、葡萄外泌体可通过植物特有miRNA或代谢物调控哺乳动物细胞炎症与修复通路,但其在耐甲氧西林jin黄色葡萄球菌(MRSA)感染伤口中协调“抗炎-修复”时间调节的机制尚未明确。

今天分享的是一篇发表在【Mater Today Bio.】(IF:10.2)上题为“Antimicrobial hydrogel loaded with broccoli exosomes promotes anti-scarring healing of MRSA-infected wounds”的研究,该研究设计了一种光交联复合水凝胶(SK@E-Au@Exos),以丝蛋白甲基丙烯酰水凝胶(SK)为载体,负载西兰花来源外泌体(Bro-Exos)和表没食子儿茶素没食子酸酯-金纳米颗粒(E-AuNPs),通过协同抗感染与免疫再生调控,实现创面“抗菌-抗炎-再生”的时序性调控,为耐药菌感染创面治疗提供创新策略。研究结果表明SK@E-Au@Exos通过其光热灭菌效果和外泌体控制释放的抗炎和修复物质,有效促进多重耐药细菌感染伤口的抗感染和抗瘢痕愈合,这不仅为感染耐药细菌的伤口提供了具有抗菌和促进愈合功能的治疗策略,也为植物外泌体跨物种应用奠定了理论基础。
研究成果
1. Bro-Exos的提取、表征及摄取
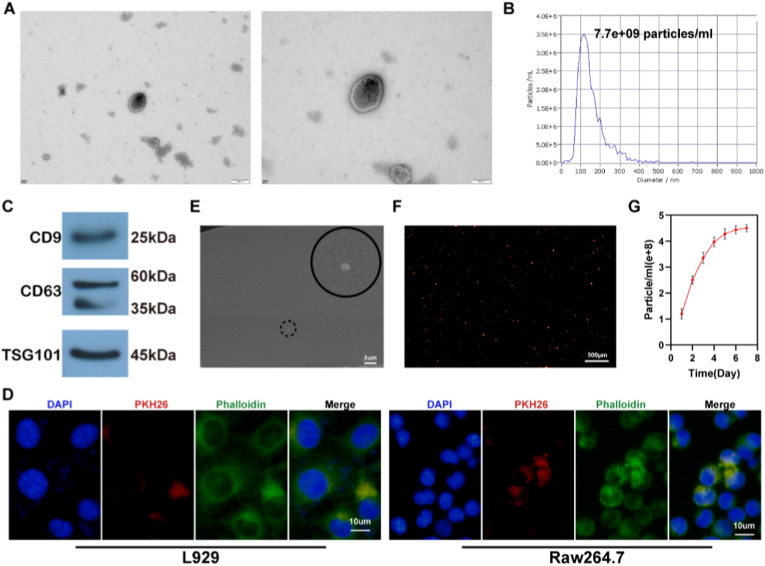
图1A:Bro-Exos的透射电子显微镜(TEM)图像。结果显示,Bro-Exos呈典型杯状囊泡结构,直径约120 nm。
图1B:对Bro-Exos进行纳米颗粒尺寸分析(NTA)。结果显示,Bro-Exos浓度为7.7×10⁹ particles/ml,粒径约120 nm,符合外泌体尺寸特征。
图1C:对Bro-Exos进行Western blot检测。结果显示,Bro-Exos高表达外泌体标志物CD9、CD63和TSG101。
图1D:PKH26标记的Bro-Exos追踪结果。结果显示,L929细胞和Raw 264.7巨噬细胞均能高效内吞Bro-Exos。
图1E:SK@E-Au@Exos的FE-SEM图像。结果显示,Bro-Exos被成功包裹在SK@E-Au水凝胶中,仍保持圆形形态,直径无明显变化。
图1F:SK@E-Au@Exos的荧光图像。结果显示,PKH26标记的Bro-Exos在水凝胶内部均匀分布,证实负载成功。
图1G:Bro-Exos的水凝胶降解实验。结果显示,Bro-Exos可从水凝胶中缓慢释放,持续释放时间超过7天。
这些结果表明,成功从西兰花中提取并鉴定出具有典型外泌体特征的Bro-Exos,其可被创面修复相关细胞摄取,且SK@E-Au水凝胶能实现Bro-Exos的长效可控释放。
2.水凝胶的制备与表征
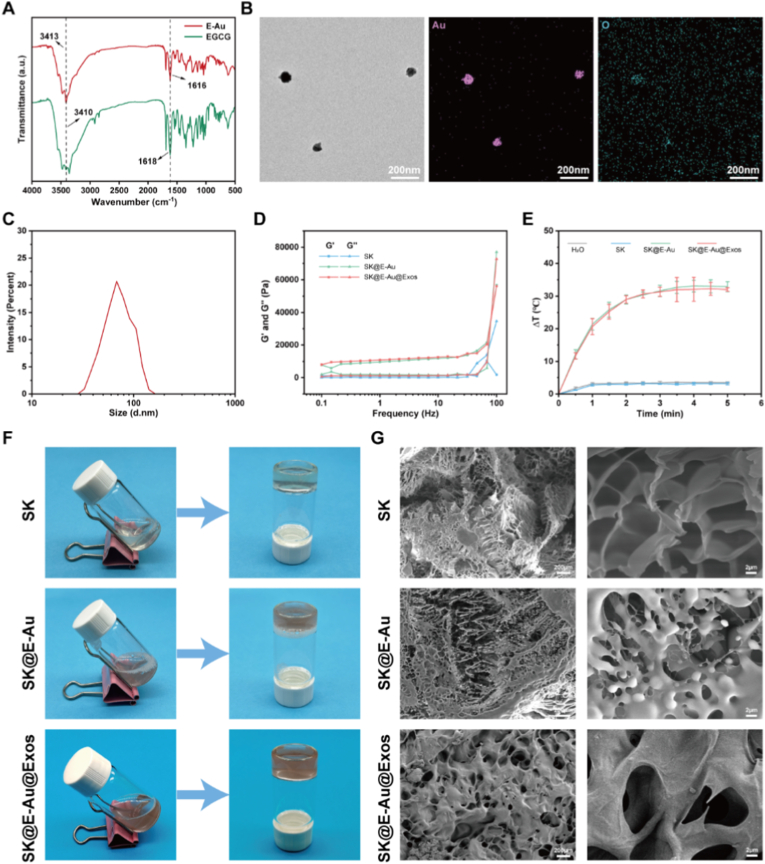
图2A:EGCG和E-Au纳米颗粒红外光谱检测。结果显示,与EGCG相比,E-Au纳米颗粒的羟基(-OH)吸收峰从3410 cm⁻¹移位至3413 cm⁻¹,羰基(C=O)吸收峰从1618 cm⁻¹移位至1616 cm⁻¹,提示羧基和羟基参与E-Au的合成与稳定。
图2B:E-Au纳米颗粒的TEM和能量色散X射线光谱仪(EDS)图像。结果显示,E-Au纳米颗粒呈均一球形,Au和O元素分布均匀,平均粒径为几十纳米。
图2C:E-Au纳米颗粒的粒度分析动态光散射法(DLS)分析。结果显示,E-Au纳米颗粒在去离子水中分散性良好,粒径约68 nm。
图2D:水凝胶的振荡频率扫描流变学分析。结果显示,水凝胶的储能模量和损耗模量随振荡频率增加而升高,E-Au纳米颗粒的加入显著提升了水凝胶的机械稳定性。
图2E:水凝胶的激光照射温度变化曲线。结果显示,808 nm近红外激光照射5 min内,SK水凝胶温度仅升高约3℃,而SK@E-Au和SK@E-Au@Exos水凝胶温度可升至约33℃,具备光热性能。
图2F:凝胶形成图。图像显示,水凝胶前驱体液体具有良好流动性,经UV照射后可快速形成稳定水凝胶。
图2G:水凝胶的SEM图像。结果显示,各组水凝胶均具有连通的多孔结构,SK@E-Au和SK@E-Au@Exos组的孔隙中可见均匀分散的颗粒。
这些结果表明成功制备了兼具良好机械稳定性、光热性能和多孔结构的SK@E-Au@Exos水凝胶,为创面修复提供了适宜的微环境。
3. SK@E-Au@Exos的抗菌性能与生物相容性
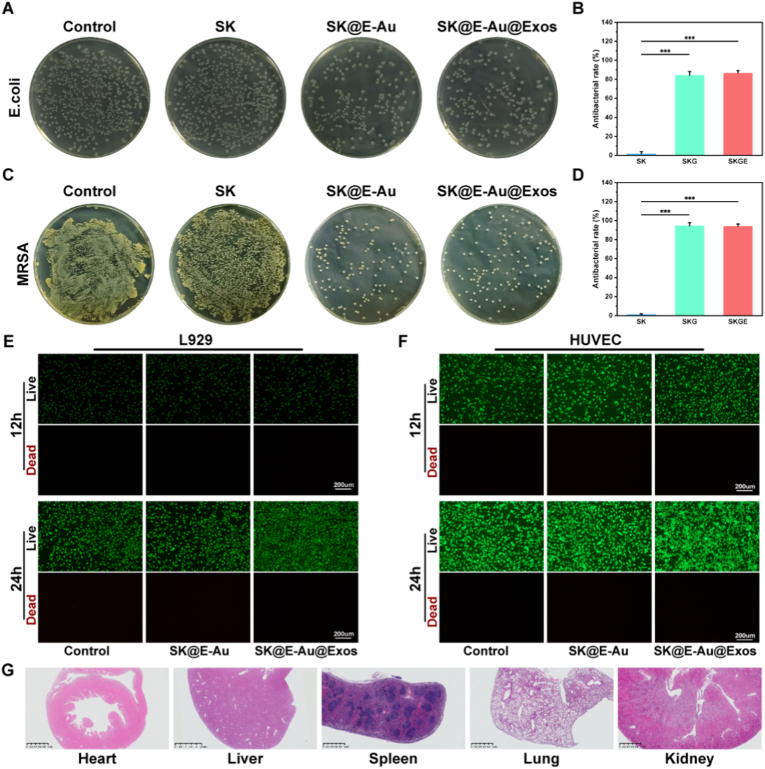
图3A:MRSA抗菌平板图。图像显示显示,SK组菌落数量与对照组接近,无明显抗菌效果;SK@E-Au和SK@E-Au@Exos组菌落数量显著减少,抗菌效果明显。
图3B:对抗MRSA的水凝胶抗菌率统计。结果显示,SK@E-Au对MRSA抗菌率为86.65%,SK@E-Au@Exos对MRSA抗菌率达94.08%。
图3C:大肠杆菌抗菌平板图。图像显示,SK组无明显抗菌作用,SK@E-Au和SK@E-Au@Exos组菌落显著减少。
图3D:对抗大肠杆菌的水凝胶抗菌率统计。结果显示,SK@E-Au对大肠杆菌抗菌率为84.36%,SK@E-Au@Exos对大肠杆菌抗菌率达94.57%。
图3E:L929细胞活死染色。结果显示,与各水凝胶组共培养后,死细胞数量少,细胞增殖趋势不受影响。
图3F:HUVEC细胞活死染色。结果显示,SK@E-Au@Exos组细胞增殖活性更高,SK@E-Au组无细胞毒性但无促增殖作用。
图3G:大鼠皮下注射SK@E-Au@Exos3个月后脏器HE染色。结果显示,心、肝、脾、肺、肾等关键脏器结构完整,无异常病变。
这些结果表明,SK@E-Au@Exos水凝胶对MRSA和大肠杆菌具有显著抗菌活性,且具备优异的细胞相容性和长期体内安全性。
4. SK@E-Au@Exos促进细胞增殖、迁移与管形成
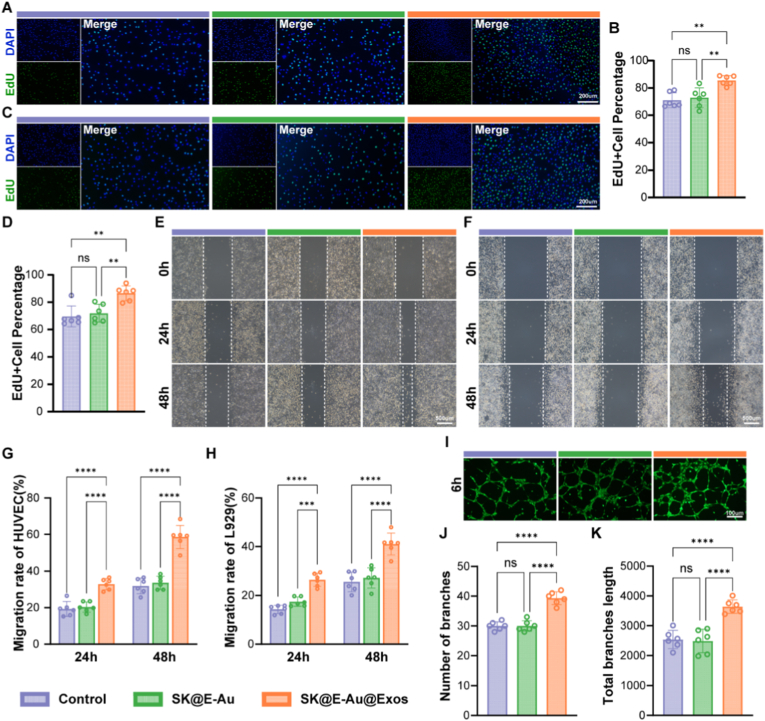
图4A-B:HUVEC细胞EdU染色及增殖率统计。结果显示,SK@E-Au@Exos组共培养24h后,细胞增殖率较对照组提升1.243倍。
图4C-D:L929细胞EdU染色及增殖率统计。结果显示,SK@E-Au@Exos组细胞增殖率较对照组提升1.204倍。
图4E-G:HUVEC细胞划痕实验及迁移率统计。结果显示,共培养48h后,SK@E-Au@Exos组细胞迁移率较对照组提升1.834倍。
图4F-H:L929细胞划痕实验及迁移率统计。结果显示,共培养48h后,SK@E-Au@Exos组细胞迁移率较对照组提升1.605倍。
图4I-K:HUVEC细胞管形成实验及定量分析。结果显示,共培养6h后,SK@E-Au@Exos组细胞管状结构分支数提升1.112倍,总分支长度提升1.172倍。
这些结果表明,SK@E-Au@Exos水凝胶能显著促进血管内皮细胞和成纤维细胞的增殖、迁移,以及血管管状结构形成,为创面再上皮化和血管再生提供支撑。
5. SK@E-Au@Exos清除ROS并逆转炎症反应
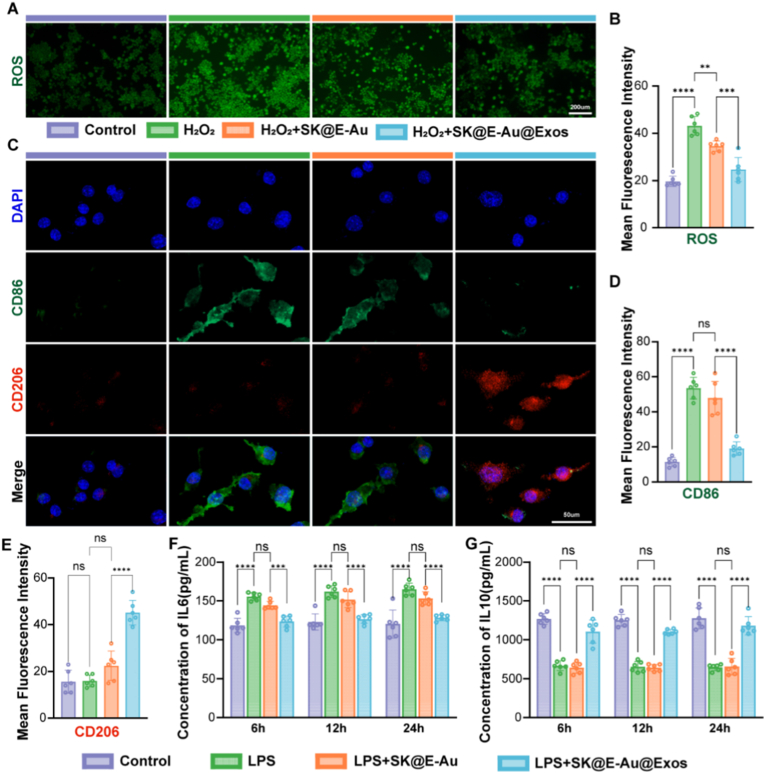
图5A-B:ROS染色及荧光强度统计。结果显示,H₂O₂诱导的巨噬细胞氧化应激模型中,SK@E-Au@Exos组ROS荧光强度显著减弱,清除效率达42.811%。
图5C-E:Raw264.7细胞免疫荧光共染色及定量分析。结果显示,LPS诱导的M1巨噬细胞经SK@E-Au@Exos处理后,M1标志物CD86荧光强度降低64.486%,M2标志物CD206荧光强度提升2.823倍。
图5F-G:ELISA检测。结果显示,SK@E-Au@Exos处理M1巨噬细胞后,促炎因子IL-6浓度降低,抗炎因子IL-10浓度升高。
这些结果表明,SK@E-Au@Exos水凝胶具有高效的ROS清除能力,可通过调控巨噬细胞表型极化,抑制促炎因子分泌、增强抗炎因子表达,从而逆转炎症微环境。
6. SK@E-Au@Exos重编程巨噬细胞
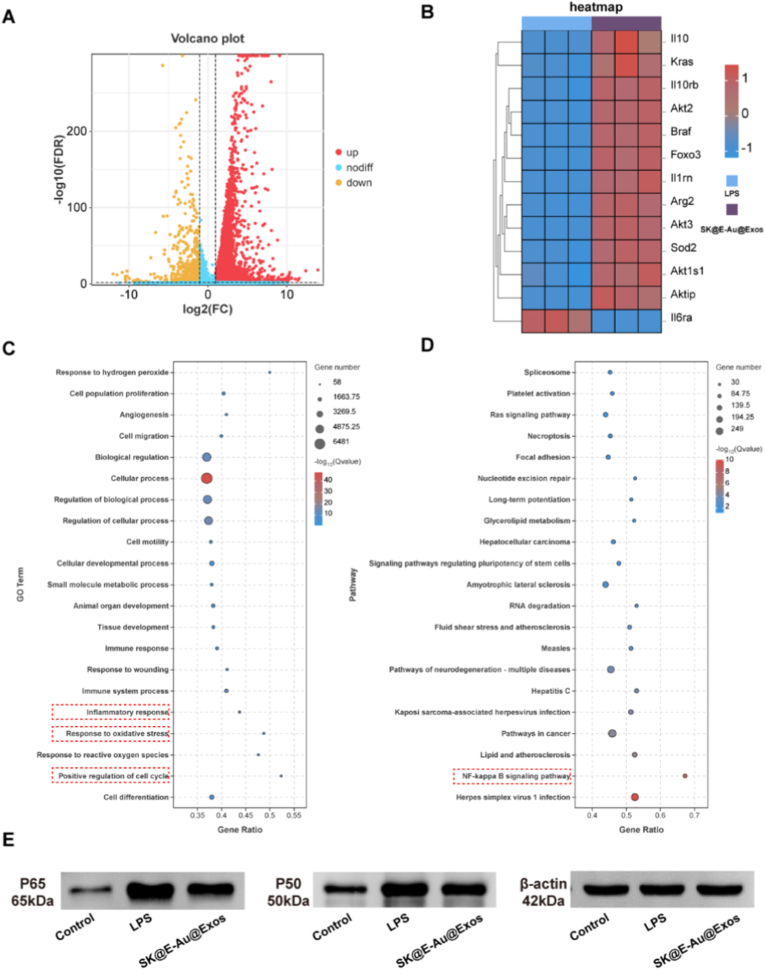
图6A:差异基因火山图。结果显示,LPS组与SK@E-Au@Exos组巨噬细胞中,共鉴定出7492个差异表达基因。
图6B:差异基因热图。结果显示,这些差异基因主要富集于抗炎、抗氧化应激、细胞增殖与迁移等功能相关通路。
图6C:GO功能富集分析。结果显示,差异基因主要参与“炎症反应”“氧化应激反应”等生物学过程。
图6D:KEGG通路富集分析。结果显示,差异基因显著聚焦于炎症反应关键通路——NF-κB通路。
图6E:Western blot检测。结果显示,SK@E-Au@Exos显著抑制NF-κB通路关键效应分子P65和P50的表达。
这些结果表明,SK@E-Au@Exos通过抑制NF-κB通路重编程巨噬细胞,驱动其向M2抗炎表型极化,为免疫微环境调控提供分子机制支撑。
7. SK@E-Au@Exos促进MRSA感染小鼠创面愈合
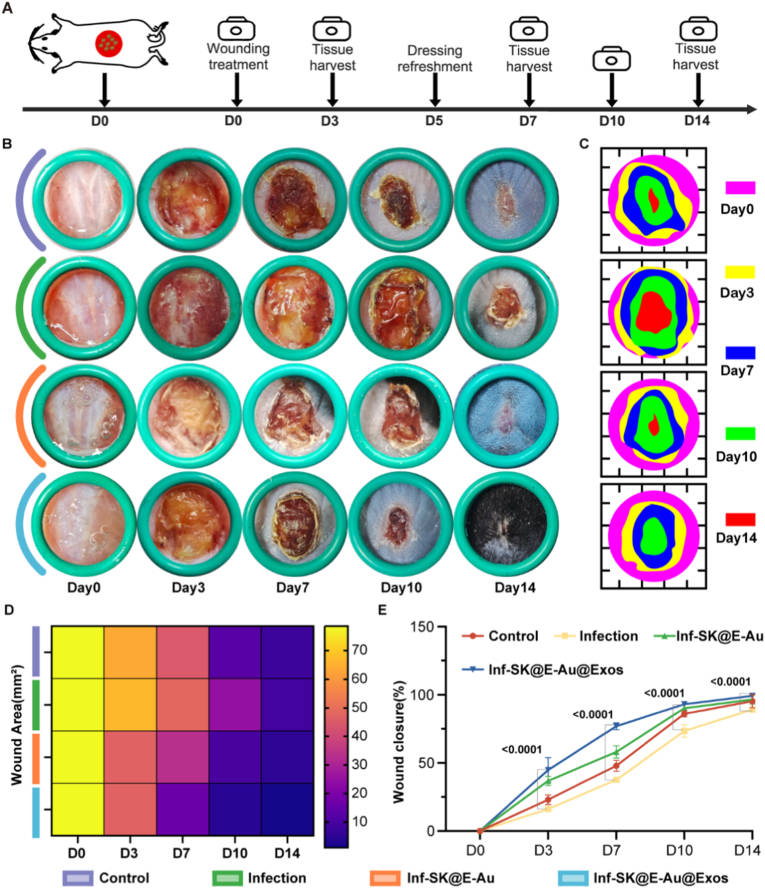
图7A:MRSA感染创面愈合时间表。
图7B:创面不同时间点照片。结果显示,感染组第3天出现明显溃疡,SK@E-Au@Exos组第3天无溃疡和脓液形成,第14天基本完全愈合且无明显瘢痕,可见新生毛发。
图7C:创面形态模拟图直观呈现各组创面收缩及愈合进程。
图7D:创面面积热图。结果显示,SK@E-Au@Exos组创面面积随时间快速缩小。
图7E:创面愈合率统计。结果显示,SK@E-Au@Exos组第7天和第14天愈合率显著高于感染组。
这些结果表明,SK@E-Au@Exos水凝胶能显著加速MRSA感染创面愈合,实现高质量无瘢痕愈合,效果优于单纯抗菌水凝胶。
8. HE和Masson染色分析
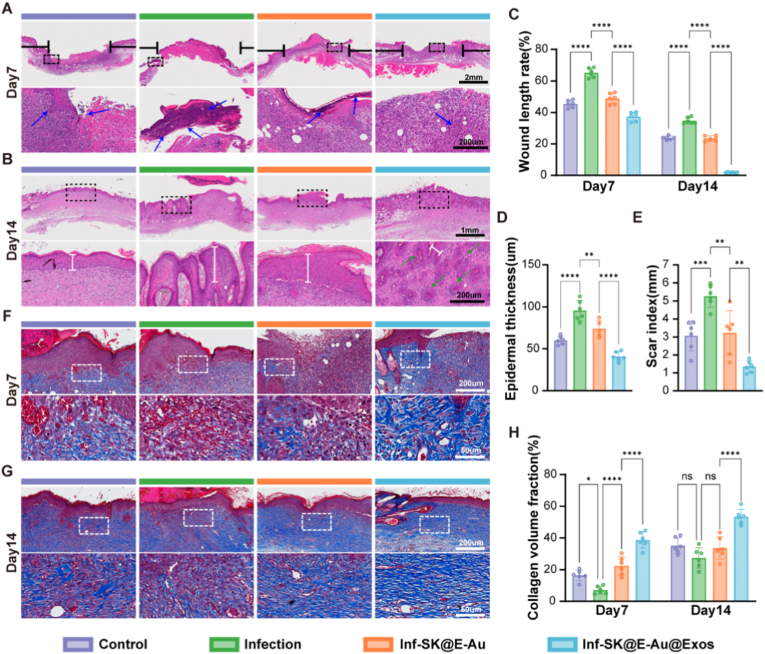
图8A-B:HE染色。结果显示,第7天感染组创面有大量炎症细胞浸润,SK@E-Au@Exos组无明显感染和炎症迹象;第14天SK@E-Au@Exos组创面表皮结构完整。
图8C:小梁长度率统计。结果显示,第7天SK@E-Au@Exos组小梁长度率显著低于感染组和SK@E-Au组。
图8D:表皮厚度统计。结果显示,第14天SK@E-Au@Exos组表皮厚度显著低于感染组。
图8E:瘢痕指数统计。结果显示,第14天SK@E-Au@Exos组瘢痕指数显著低于感染组。
图8F-G:Masson染色。结果显示,第14天SK@E-Au@Exos组胶原纤维排列更有序。
图8H:胶原体积分数统计。结果显示,第14天SK@E-Au@Exos组胶原体积分数达53.404%±2.278%,显著高于感染组。
这些结果表明,SK@E-Au@Exos水凝胶能抑制创面炎症浸润,促进表皮修复和胶原有序沉积,显著降低瘢痕形成风险,提升愈合质量。
9. SK@E-Au@Exos在体内清除ROS并抑制炎症
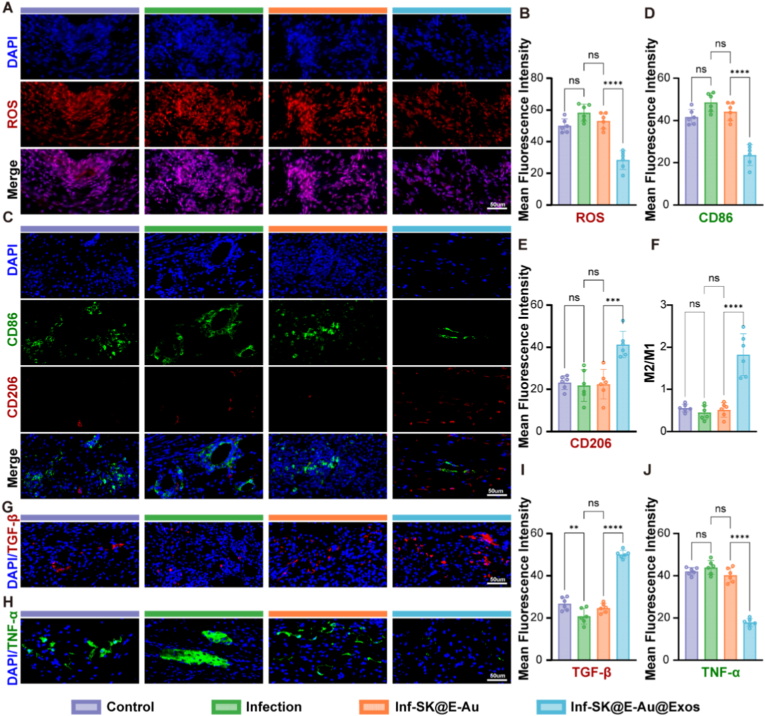
图9A-B:第3天创面组织ROS染色及定量分析。结果显示,SK@E-Au@Exos组ROS荧光强度显著降低,清除率达51.418%。
图9C-E:第7天创面组织CD206/CD86免疫荧光共染色及定量分析。结果显示,SK@E-Au@Exos组CD206荧光强度显著增强,CD86荧光强度显著下调,M2/M1比值升高。
图9F:M2/M1比值计算。结果显示,SK@E-Au@Exos组显著高于感染组。
图9G-I:第7天创面组织TGF-β荧光染色及定量分析。结果显示,SK@E-Au@Exos组TGF-β表达较感染组提升。
图9H-J:第7天创面组织TNF-α荧光染色及定量分析。结果显示,SK@E-Au@Exos组TNF-α表达较感染组降低。
这些结果表明,SK@E-Au@Exos在体内可通过清除ROS、重编程巨噬细胞极化、抑制促炎因子并增强抗炎修复信号,实现创面“抗菌-抗炎-再生”的时序性调控。
10. SK@E-Au@Exos促进血管形成与再上皮化
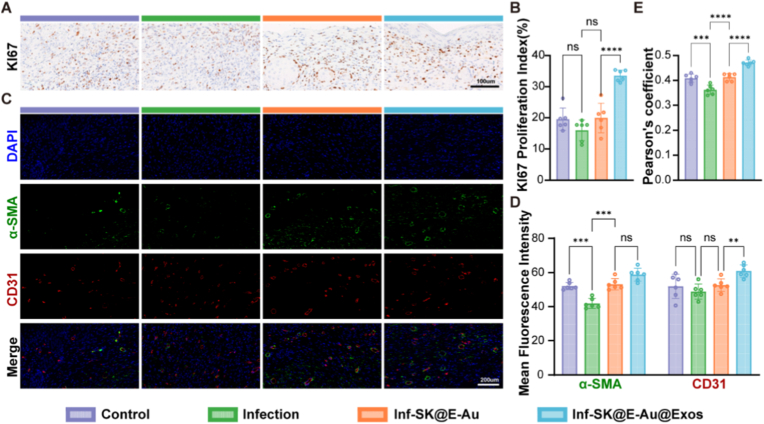
图10A-B:第7天创面组织KI67免疫组化及定量分析。结果显示,SK@E-Au@Exos组创面边缘表皮基底层细胞增殖活性显著增强,KI67阳性率较感染组提升。
图10C-D:第14天创面组织CD31/α-SMA免疫荧光共染色及定量分析。结果显示,SK@E-Au@Exos组CD31平均荧光强度提升1.246倍,α-SMA平均荧光强度提升1.402倍。
图10E:Pearson共定位系数定量分析。结果显示,SK@E-Au@Exos组皮尔逊共定位系数(PCC)显著高于感染组和对照组。
这些结果表明,SK@E-Au@Exos水凝胶能促进创面表皮细胞增殖,加速再上皮化进程,同时逆转MRSA感染导致的血管结构破坏,提升血管成熟度。
结论
本研究成功构建了负载西兰花外泌体和E-Au纳米颗粒的复合水凝胶SK@E-Au@Exos,其兼具显著的抗菌活性、ROS清除能力、抗炎功能及促修复特性,该水凝胶通过 “抗菌-抗炎-再生”的时序性调控,为耐药菌感染创面的临床治疗提供了兼具抗感染和促愈合功能的创新策略。






